고효율 해수수전해 양극 산소발생반응용 황이 포함된 니켈-철 이중 층 수산화물 촉매
Sulfur-Incorporated Nickel-Iron Layered Double Hydroxides for Effective Oxygen Evolution Reaction in Seawater
Article information
Trans Abstract
Given the abundance of water on the surface of the Earth, water splitting using seawater may be an effective solution to the future energy crisis. However, oxygen evolution reaction (OER) electrocatalysts require several specific characteristics to be used in seawater electrolysis, such as high catalytic activity, selectivity, and resistivity against chlorine corrosion. This paper reports that sulfur incorporation into nickel– iron layered double hydroxide (NiFe-LDH-S) can fulfill the abovementioned requirements for seawater oxidation. Sulfidation was performed on NiFe-LDH nanosheets homogeneously grown on a porous carbon scaffold via a facile chemical vapor deposition (CVD) process. The best NiFe-LDH-S sample demonstrated excellent catalytic activity with a high corrosion resistance for seawater oxidation.
1 서론
수전해는 지속 가능한 에너지를 활용하면서 부가 가치 화학 물질(예: 수소)을 생산하는 가장 유망한 방법 중 하나다.[1–5] 현재 상업용 수전해기는 KOH 조건에서 고도로 정제된 물을 필요로 한다.[6,7] 바다가 지구 전체 물의 95% 이상을 보유하고 있다는 점을 감안할 때 해수를 시작 공급원료로 사용하여 전기화학적 물 분해를 통해 직접 수소를 생산하는 것이 적합하다. 그러나 이것은 주로 양극 재료 특성과 관련된 최첨단 요구 사항으로 인해 달성하기 어렵다.[8–15] 구체적으로, 해수분해용 음극재는 높은 촉매 활성, 산소 발생 반응(OER)에 대한 높은 촉매 선택성, 염화물 부식에 대한 높은 내성이 요구된다. 촉매는 OER에 대해 높은 활성을 갖지만, 고 활성 염화 음이온은 금속 염화물-수산화물의 형성을 통해 수많은 촉매 또는 기질을 파괴할 수 있다.[9]
Dai et al. 최근에 해수 산화를 위한 고성능 양극 전극 촉매 설계를 위한 새로운 전략을 보고했다. 특히, 양극산화 공정을 통해 다중 음이온 황산염/탄산염 부동태화 NiFe-LDH를 개발했으며, 여기서 음으로 하전 된 S2-이온은 해수에서 Cl-음이온을 효과적으로 제거하여 염소 부식에 대한 내성을 향상시킨다. NiFe-LDH의 OER 에 대한 본질적으로 높은 선택성 외에도 황은 전기 촉매 해수 산화를 향상시키는 데 두 가지 중요한 역할을 한다. 특히, 전기 전도성을 향상시키는데 음이온이 풍부한 음이온 표면을 생성한다. 따라서 NiFe-LDH 표면에 황을 원자 규모로 합성하는 것은 해수 산화를 위한 고성능 전기 촉매 개발에 적합한 방법이다.
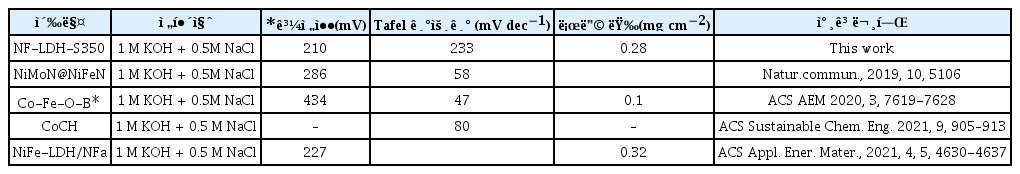
황화는 습식 화학 반응, 액상 코팅, 마이크로파 및 화학 기상 증착(CVD)과 같은 여러 방법을 사용하여 물리화학적 특성을 개선하기 위해 기능성 나노 물질에 널리 적용되었다.[16–20] 이 중 CVD를 사용한 황화는 대규모 양극 전극에 황 원자를 균일하게 합성하는데 적합하므로, 보다 실용적이다. 또한, CVD를 이용한 황 원자의 기상 혼입은 NiFe-LDH의 나노 구조(즉, 2차원 나노 시트 형태)를 파괴하지 않는다. 이는 전기 촉매 활성을 향상시킨다. 이 논문은 손쉬운 CVD 방법을 통해 다 공성 carbon cloth(CC)에서 조밀하게 성장한 황이 도핑 된 NiFe-LDH 나노 시트 (NiFe-LDH-S)에 대해 보고한다. 생성된 촉매는 해수 산화에 대한 우수한 촉매 활성 및 안정성을 나타내어 귀금속 기반 촉매보다 성능이 뛰어나다. 특히, 최적의 NiFe-LDH-S350 촉매는 100 mA cm−2의 전류밀도에서 296mV의 과전위를 보였으며 233 mV dec−1의 Tafel 기울기를 나타냈는데 이는 해수 산화에 대한 우수한 전기 촉매 안정성을 보인다. 또한 NiFe-LDH와 비교하여 NiFe-LDH-S350은 중요한 고유 촉매 활성 지표인 turn over frequency (TOF)가 22% 증가하고 활성화 에너지 (Ea)가 37% 감소했다.
2 실험 재료 및 과정
2.1 재료
Nickel (II) chloride hexahydrate, iron (II) chloride tetrahydrate, ammonium fluoride, urea 화학 물질은 Sigma Aldrich에서 구입했으며 추가 정제 없이 받은 그대로 사용했다.
2.2 촉매 합성
2.2.1 기판의 준비
3cm × 3cm 크기의 CC 기판을 질산과 DI water (3:1의 부피 비) 용액에서 연속 교반 하면서 100°C에서 1시간동안 활성화했다. 그런 다음 기판을 DI water와 에탄올을 사용하여 철저히 세척하고 세척된 CC는 실온에서 밤새 건조시켰다.
2.2.2 Ni-LDH의 제조
세척된 CC를 0.5cm × 3cm 크기의 작은 샘플로 잘라낸다. nickel (II) chloride hexahydrate (2.02g), ammonium fluoride (0.5924g) 및 urea (2.4024g)를 DI 100ml에 넣어 용액을 만든다. 앞의 용액과 CC를 120mL Teflon-liner에 담은 후 이를 Stainless Steel Autoclave에 넣어 전기 오븐으로 옮긴 후 120°C, 3시간 동안 수열합성 하였다. 합성 후 Autoclave를 전기오븐 에서 실온으로 냉각시켰다. 생성된 생성물을 DI water 와 에탄올을 사용하여 철저히 세척한 후 실온에서 건조시켰다.
2.2.3 NiFe-LDH의 제조
NiFe-LDH의 합성은 위의 DI 용액에 iron (II) chloride tetrahydrate (0.298g)을 첨가한 것을 제외하고 Ni-LDH의 합성과 동일하였다.
2.2.4 NiFe-LDH-S의 제조
준비된 NiFe-LDH와 황 파우더는 각각의 alumina boat에 담았다. NiFe-LDH는 관 중앙에 배치하고, 황 파우더는 상류 운반선 가스(Ar) 주입 지점인 관 끝에 배치했다. 황화 조건을 최적화하기 위해 350 °C, 400 °C 및 450 °C의 서로 다른 온도로 테스트되었다. 가열 속도는 50 °C/10 분으로 설정되었고 열처리 시간은 1시간이었다. 촉매 로딩 량은 추후 전기분해 실험 전후에 각각의 CC와 연결된 self-supported LDH를 측정하여 측정되었다.
2.3 전기화학적 측정
전기 촉매 특성은 potentiostat (Autolab PGSTAT, Metrohm)에 연결된 3전극 시스템을 사용하여 시뮬레이션 해수 조건(1M KOH 및 0.5M NaCl)에서 테스트되었다. 작업 전극은 CC에서 자란 촉매를 사용하였으며 전해질 내에서는 활성 표면(면적 = 0.25 cm2)만 반응할 수 있게 노출시켰다. 기준 전극과 상대 전극은 각각 Ag/AgCl과 Pt를 사용하였다. 전해질은 전기화학적 측정 전에 약 20분 동안 Ar 가스를 사용하여 purging 되었다. 선형 주사전압전류법 (LSV)은 5 mV s−1의 스캔 속도로 수행되었다. 측정된 전위는 가역적 수소 전극(RHE) 전압에 대해 보정되었다. 그 후, 특별히 언급하지 않는 한 모든 LSV 곡선에 대해 iR-correction이 수행되었다. 전기화학적 임피던스 스펙트럼 분석(EIS)은 개방 회로(OC) 전압에서 0.1~100 kHz 주파수 범위 내에서 5 mV의 사인파 진폭으로 수행되었다. 비교를 위해 벤치마크 IrO2 촉매 분말을 지름 3㎜의 glassy carbon(GC) 전극에 코팅했고, 회전디스크전극(RDE) 시스템을 이용해 LSV를 측정하였다.
2.4 특성
SEM(model S4800; Hitachi)과 TEM(Talos F200X; Thermo Fisher Scientific)은 샘플의 형태학과 원소 분포를 조사하기 위해 EDS와 함께 수행되었다. 또한, XRD(D/MAX-2500/PC; Rigaku)는 40kV 및 100mA 에서 회절계를 갖는 Cu-Kα 소스(λ = 0.15418nm)를 사용하여 수행되었다. 샘플 표면의 전자 구성은 서베이 및 고해상도 스캔에 대해 각각 100eV 및 20eV의 통과 에너지로 XPS(VG ESCALAB 200i; Thermo Fisher Scientific)를 수행하여 연구되었다.
3 결과 및 고찰
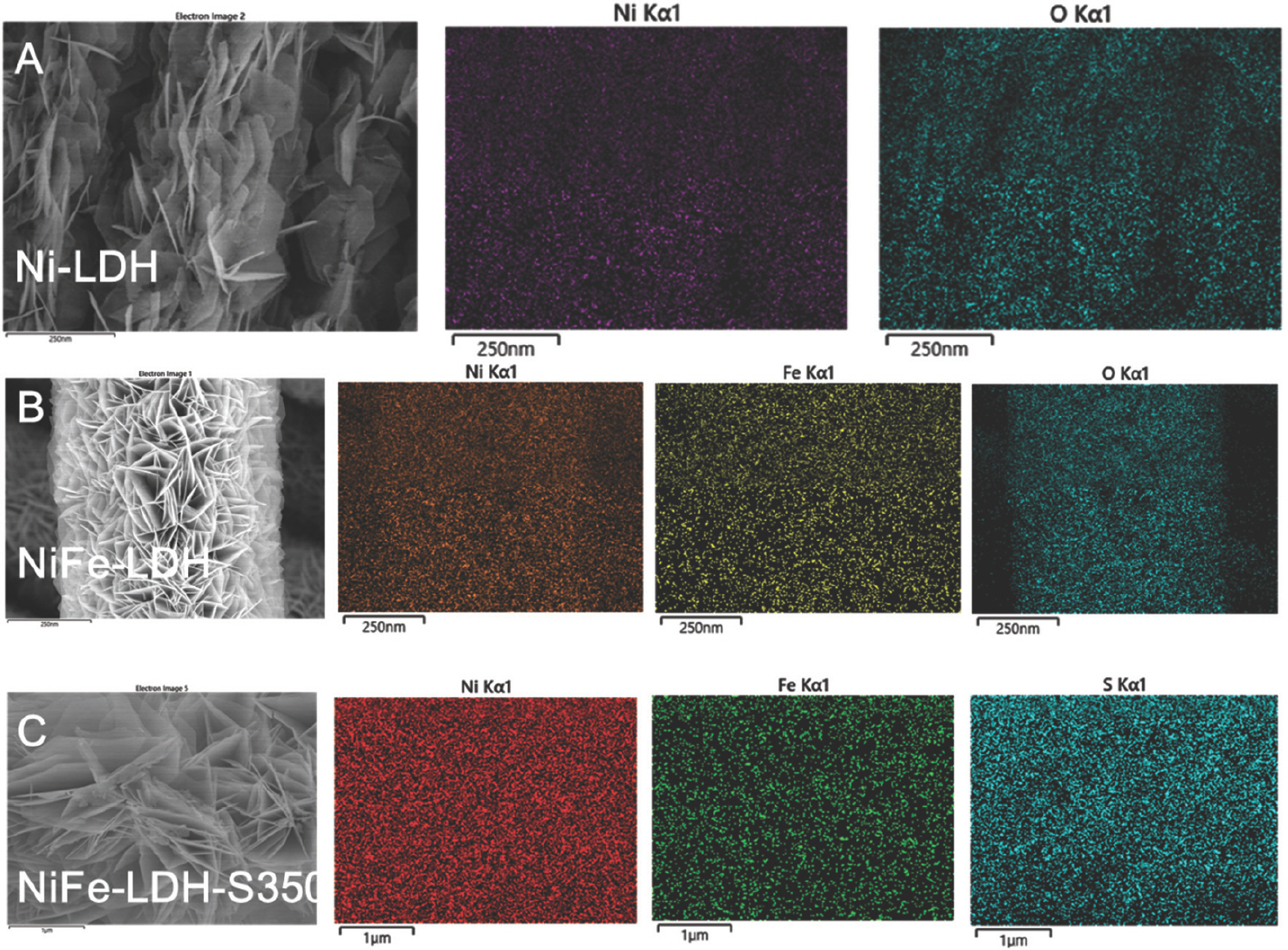
성장한 Ni-LDH와 NiFe-LDH는 LDH의 전형적인 형태인 뚜렷한 2차원(2D) 나노 시트 구조를 나타냈다 (Fig. 1 및 Fig. 2).

(a-c) Ni-LDH, d-f) NiFe-LD및 (g-i) NiFe-LDH-S350의 SEM 이미지. (j) Ni-LDH, NiFe-LDH, NiFe-LDH-S350, NiFe-LDH-S400, NiFe-LDH-S450의 XRD 회절도.
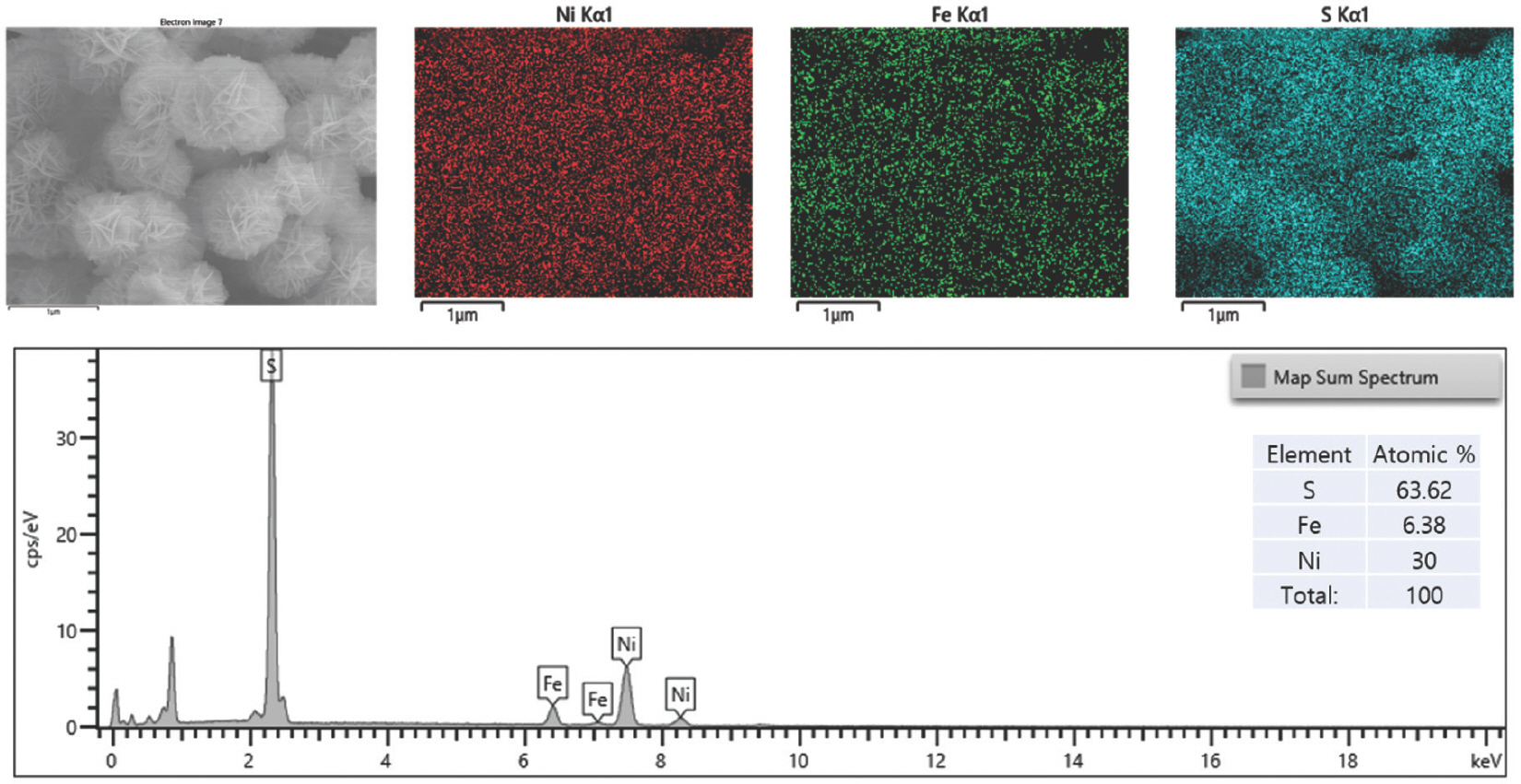
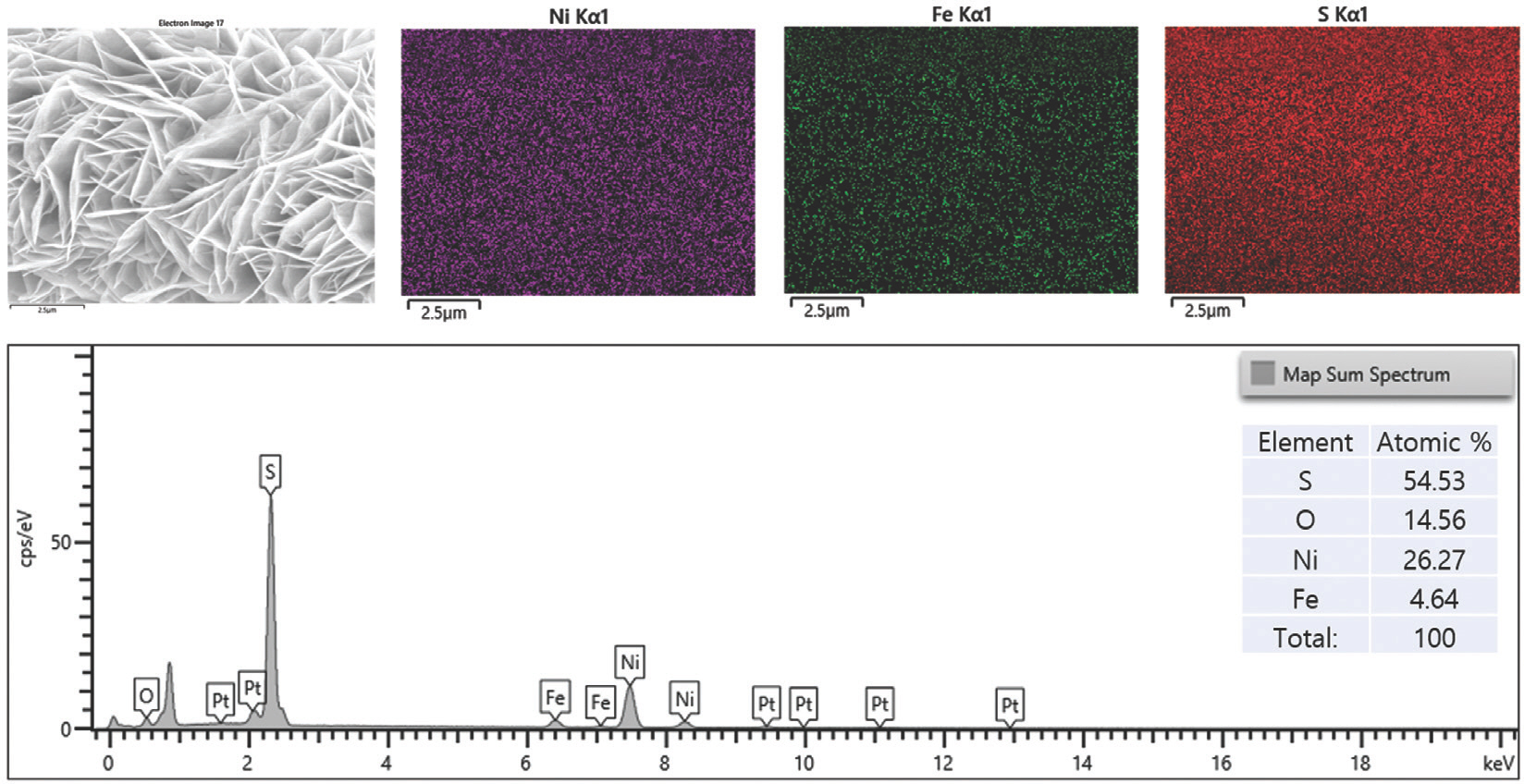
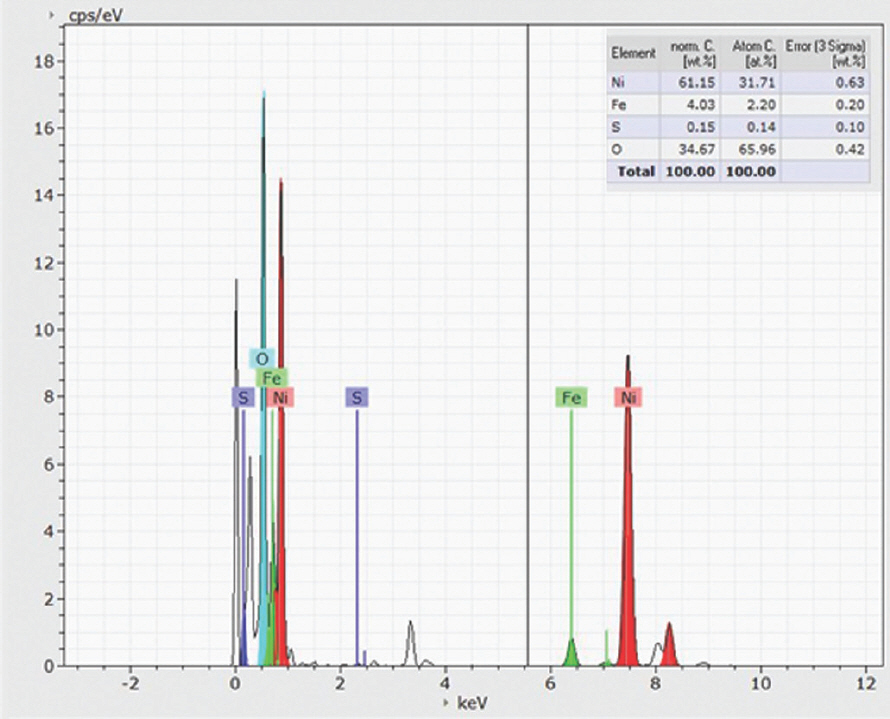
또한, EDS 결과는 Ni, Fe, O가 LDH 나노 시트에 균일하게 분포되어 있음을 확인하였다 (Fig. 3). 황화 후 NiFe-LDH-S350 및 NiFe-LDH-S400의 경우 깨끗하고 견고한 나노 시트 구조가 잘 유지된 반면, NiFe-LDH-S450의 경우 LDHs 나노 시트의 상당한 응집력이 관찰되었다. 이는 자연 그대로의 나노 시트 구조를 파괴하지 않고 황 원자를 LDH에 성공적으로 결합시키기 위해선 NiFe-LDH가 400°C를 초과하는 황화 온도는 적합하지 않음을 나타낸다. 또한, EDS 결과는 황화 과정 동안 황이 NiFe-LDH 기질에 성공적으로 도핑 되었음을 보여주었다 (Fig. 3–Fig. 5).
NiFe-LDH-S400과 NiFe-LDH-S450에 대한 정량적 EDS 결과에서 관찰된 바와 같이 O 피크의 유의한 감소가 있었다 (Fig. 5). 이는 수산화물에서 황화물로의 완전한 상 변환이 두 샘플에서 모두 발생했음을 의미한다.
샘플의 결정 구조를 보여주는 XRD profiles은 Fig. 1에 나타냈다. Fig. 1j는 Ni-LDH 및 NiFe-LDH가 전형적인 니켈 기반 LDH 결정 구조(α-Ni(OH)2, JCPDF: 00-038-0715)를 나타냈음을 보여준다. 그러나 황화 처리 후 약 11.5°에서 LDH의 (003) 회절 피크는 관찰되지 않은 반면, 30°에서 뚜렷한 회절 피크가 관찰되었으 며 이는 nickel iron sulfides(JCPDF: 01-077-1624)의 (100) 회절 피크와 일치한다. 또한 NiFe-LDH-S350은 17°에서 회절 피크를 나타냈는데, 이는 nickel iron sulfates의 결정구조(JCPDF: 01-081-0019)에 기인한 것으로 볼 수 있다. 이는 NiFe-LDH-S350이 nickel iron sulfide와 sulfate의 혼합상이 포함된 LDH 구조를 이루고 있음을 나타내며, 이는 정량적 EDS 결과와 일치한다. 특히 전이 금속 수산화물은 알칼리성 OER에 대해 높은 친화성을 갖는 반면, 전이 금속 황화물은 염소 이 온에 대한 내식성이 높다. 따라서 서로 다른 두 가지의 장점 때문에 NiFe-LDH-S350에 대한 고성능 해수 산화가 예상되었다.
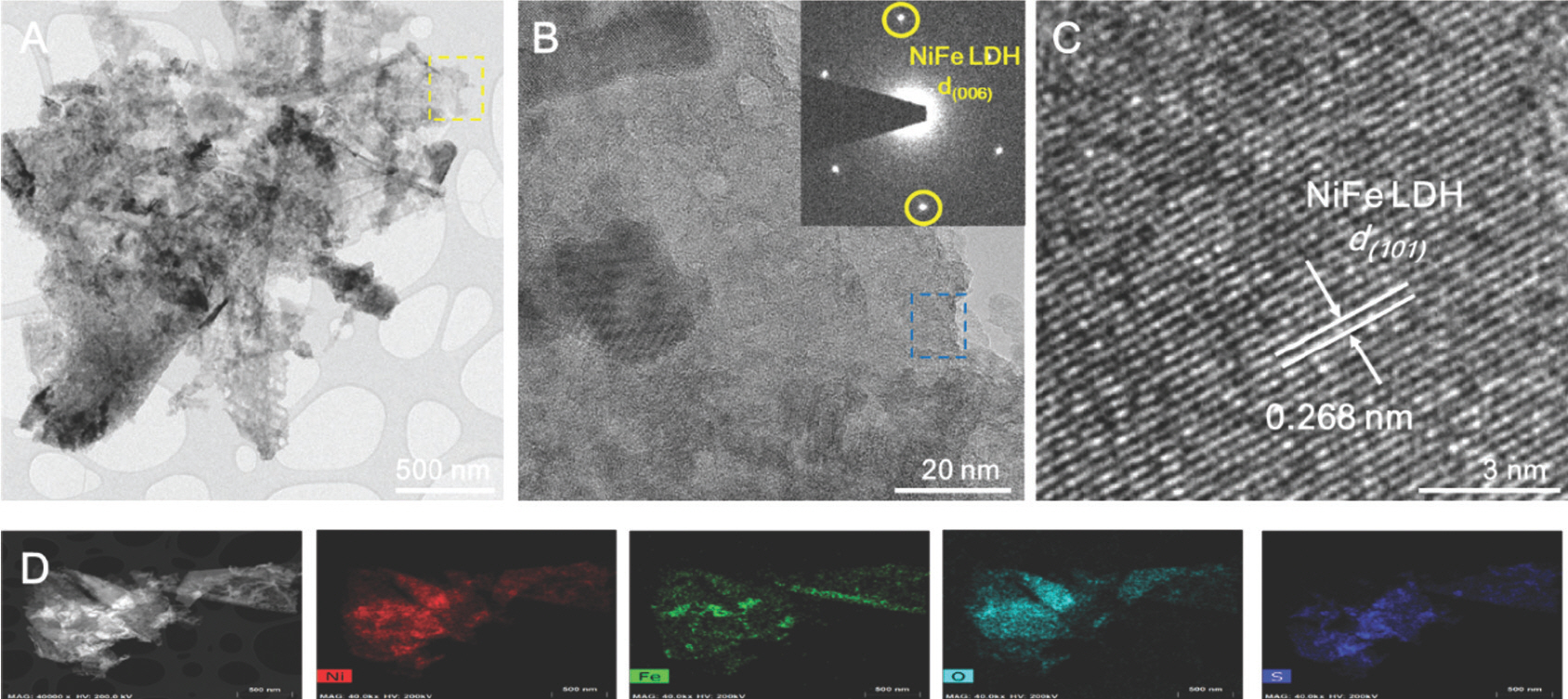
NiFe-LDH-S350의 TEM 이미지는 Fig. 6a 에 나와 있으며, 이는 전이 금속 LDH의 전형적인 독특한 2D 나노 시트 형태를 나타낸다. HR-TEM 이미지와 해당하는 selected area electron diffraction (SAED) 패턴에서 볼 수 있듯이, NiFe-LDH-S350은 다결정질 특성을 보인다 (Fig. 6b 및 삽입). 또한 0.268 nm 크기의 투명한 격자 무늬가 관찰되었는데, 이는 NiFe-LDHs 의 면간 격자 거리 (101)에 기인한다 (Fig. 6c). NiFe-LDH-S350의 화학 성분을 확인하기 위해 STEM의 EDS를 수행하였는데 Ni, Fe, O, S가 나노 시트 표면에 균일하게 분포되어 nickel iron sulfide나 sulfates의 성공적인 형성을 입증하였다 (Fig. 6d).
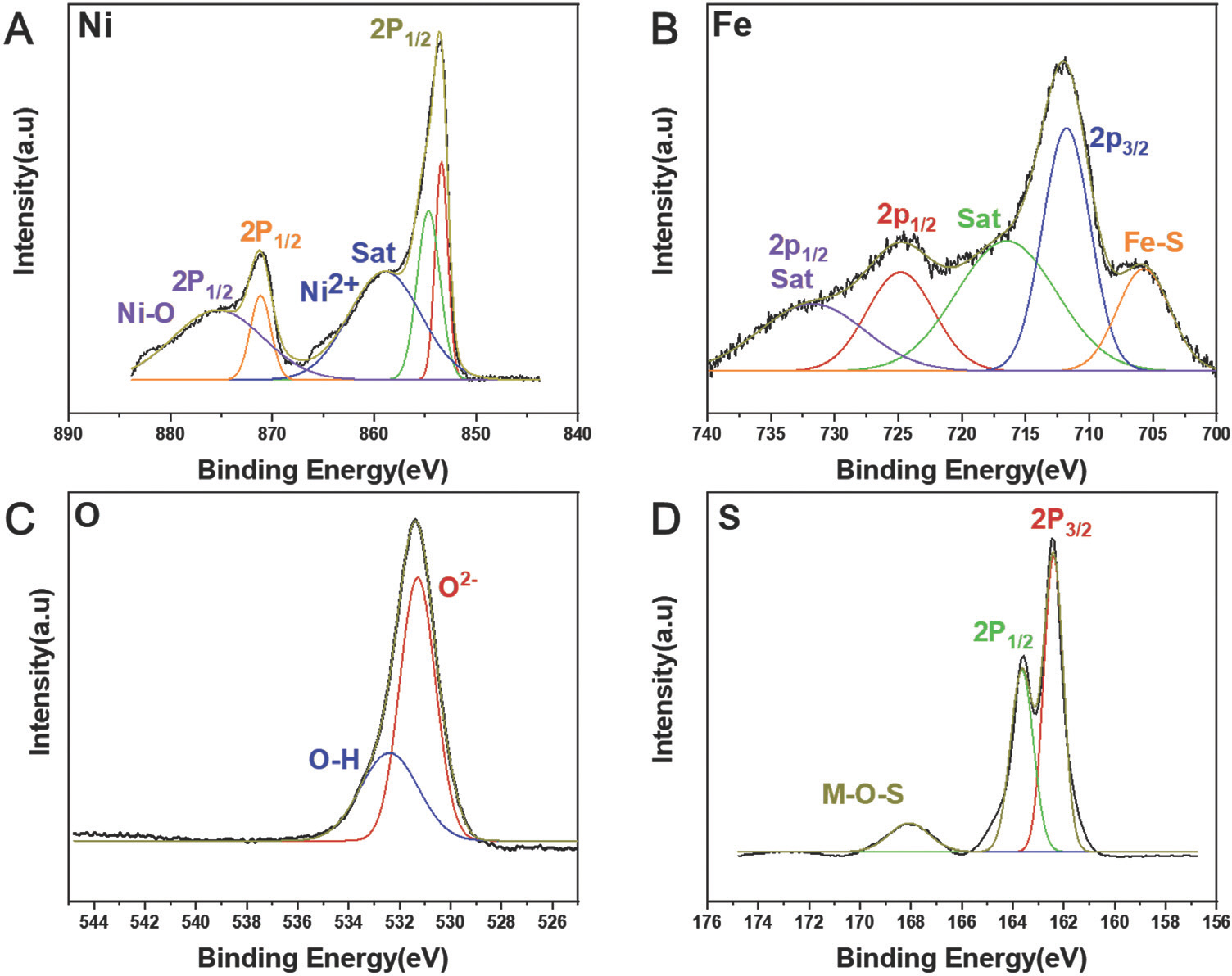
시료에서 Ni, Fe, O, S의 정량적 양은 각각 41.63 at%, 3.37 at%, 23.74 at%, 31.26 at%로 측정되었다(Fig. 7). NiFe-LDH-S350의 표면 전자 구성을 광범위 하게 조사하기 위해 XPS를 수행했다.
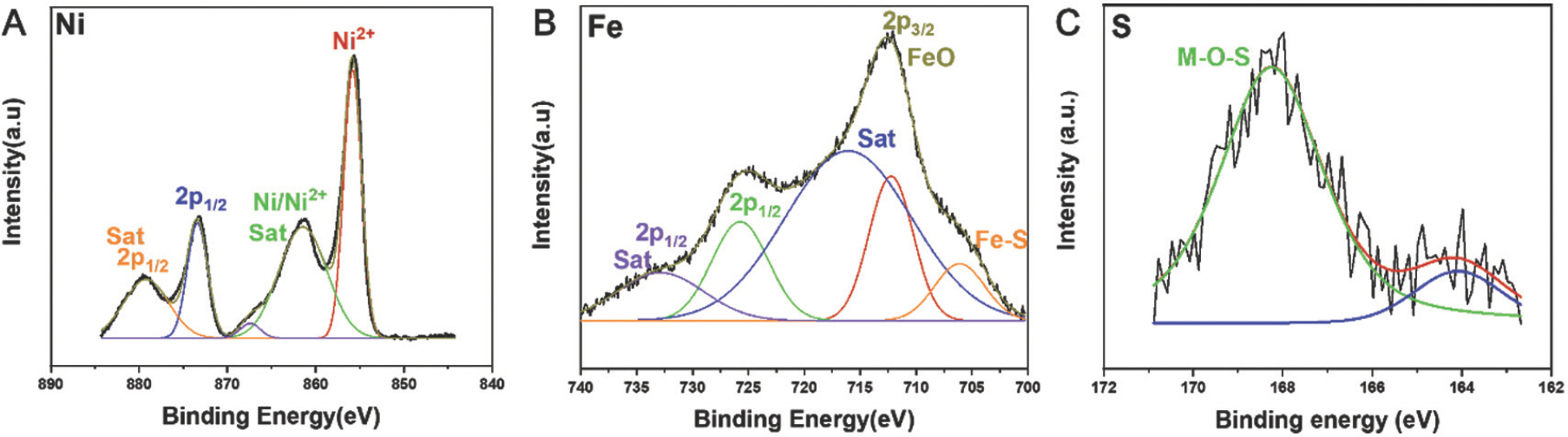
Fig. 8과 같이 Ni 2p의 XPS 스펙트럼은 853.50eV 및 871.08eV의 결합 에너지를 갖는 두 개의 스핀 궤도 이중선, 즉 각각 Ni 2p3/2와 Ni 2p1/2를 나타냈다(Fig. 8a).[21] 두 개의 satellite 피크가 858.9 eV 및 875.72 eV 에서 관찰되었으며, 이는 샘플에서 Ni의 2+ 원자가 상태를 나타낸다. Fe 2p 스펙트럼의 경우, 두 샘플 모두 Fe에 대해 2+와 3+의 혼합원자가 상태가 관찰되었다(Fig. 8b). O1s 스펙트럼의 경우, 금속-산화물(M-O)과 금속-수산화물(M-OH)에 대한 결합 에너지는 각각 531.39eV와 532.40eV에서 관측되었다(Fig. 8c).[22] S 2p의 XPS 스펙트럼은 NiFe-LDH-S350 (Fig. 8d)[23]에서 M-S(162.4 eV)와 M-O-S(168.36 eV) 결합의 공존을 나타내며, 이는 XRD결과에서 관찰된 바와 같이 황화물과 수산화물의 혼합상을 나타낸다.
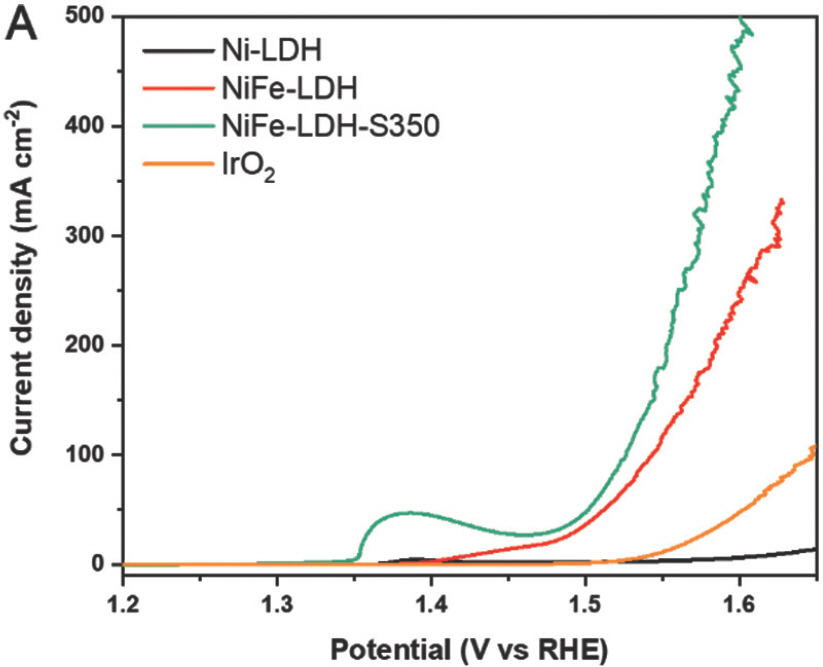
전기 촉매 해수 산화는 3전극 시스템에 연결된 potentiostat 장비를 사용하여 1.0M KOH 및 0.5M NaCl로 시뮬레이션 된 해수 전해질에서 테스트되었다. LSV polarization 곡선을 얻기 전에 샘플 표면을 전기화학적으로 안정화하기 위해 1.23~1.65 V RHE의 전위 범위 내에서 CV를 50 사이클 동안 수행했다. Ni-LDH, NiFe-LDH 및 NiFe-LDH-S350에 대해 얻은 LSV 곡선은 Fig. 9a에 나와 있다.
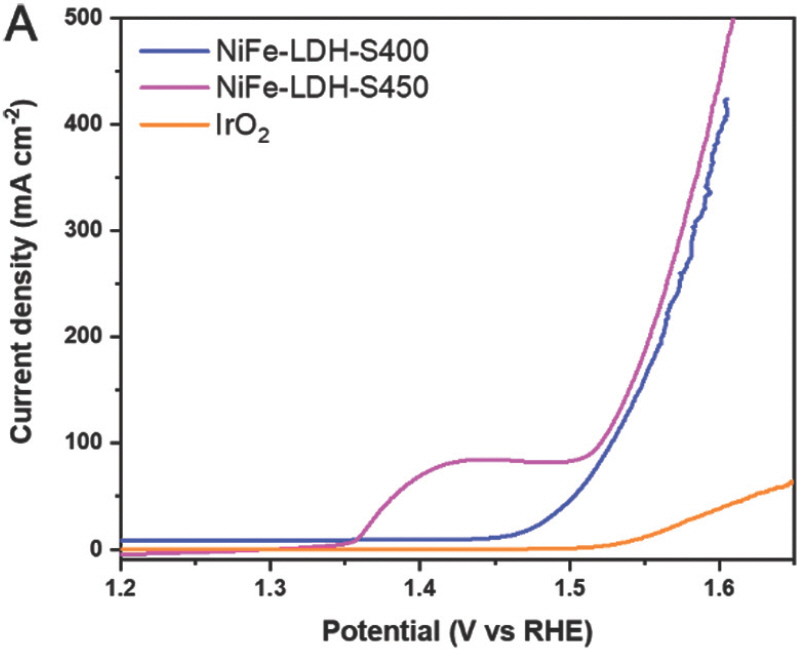
약 1.38 V RHE에서 산화 피크는 Ni 2+에서 Ni 3+로의 산화로 인한 것이며, 이는 일반적으로 물 산화를 위한 니켈 기반 전기 촉매에서 관찰된다[21]. 100 mA cm−2 (η100)의 전류밀도에서 과전위는 NiFe-LDH와 NiFe-LDH-S350에 대해 각각 314mV 및 296mV로 얻었다. Ni-LDH 및 벤치마크 IrO2 샘플은 측정된 전위 범위 내에서 100 mA cm−2의 전류 밀도에 도달할 수 없었다는 점에 유의해야 한다. 또한 NiFe-LDH-S400과 NiFe-LDH-S450은 각각 100 mA cm−2에서 298mV와 290mV의 과전압을 보였다(Fig. 10a).
NiFe-LDH-S 샘플은 NiFe-LDH보다 우수한 촉매 활성을 나타내어 황화가 NiFe-LDH의 해수 산화 활성을 효과적으로 향상시킬 수 있음을 보여준다.
전기화학 반응에서 Tafel 기울기는 주어진 촉매의 반응 역학 평가에 매우 중요하다.[24] 샘플의 Tafel plot은 해당하는 LSV 곡선에서 얻었다. Tafel 기울기는 다음과 같이 계산되었다.
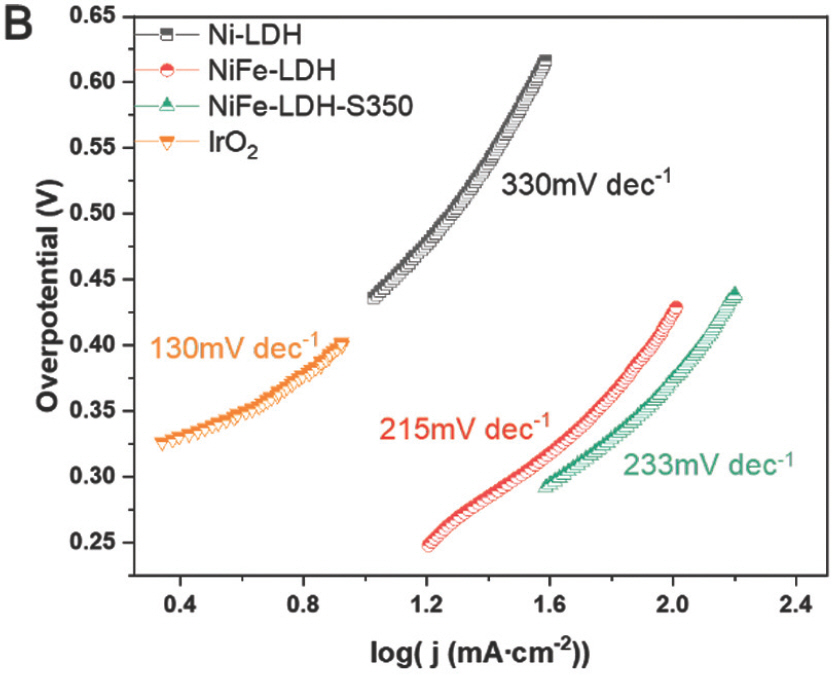
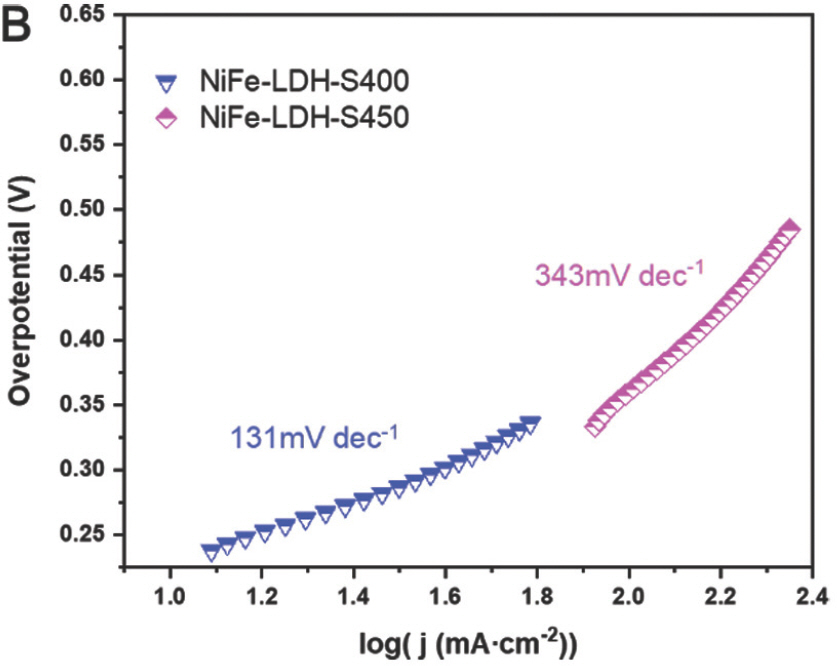
:η=b×logj+a,여기서 η, j 및 b는 각각 과전압, 전류밀도 및 Tafel slope다. 일반적으로 작은Tafel slope는 빠른 반응 kinetics를 나타냄. Ni-LDH, NiFe-LDH, NiFe-LDH-S350, NiFe-LDH-S400 및 NiFe-LDH-S450의 Tafel slope는 330mV dec−1, 215mV dec−1, 233mV dec−1, 131mV dec−1 및 343mV dec−1 로 계산되었다. (Fig. 9b 및 Fig. 10b)
또한, NiFe-LDH 및 NiFe-LDH-S350은 유사한 Tafel 기울기를 나타낸 반면, NiFe-LDH-S400은 테스트된 샘플 중에서 가장 낮은 Tafel 기울기를 나타냈다. 이것은 전이 금속 황화물이 칼코제나이드의 높은 전기 전도도로 인해 손쉬운 OER 역학을 촉진한다는 것을 나타낸다.[25] 그러나 NiFe-LDH-S450은 가장 낮은 Tafel 기울기를 나타내어 위의 가정과 모순된다. NiFe-LDH-S450의 경우 SEM 이미지에 표시된 대로 LDH 나노 시트의 심각한 응집이 관찰되어 물 산화 중 용이한 물질 전달을 차단하고 OER kinetics을 방해한다는 점에 유의해야 한다. 따라서 손쉬운 OER kinetics을 실현하려면 용이한 전하와 물질 전달이 동시에 이루어져야 한다. 촉매 표면과 산화환원 물질 사이의 계면에서 전하 이동 저항(Rct) 은 0.1–100kHz 범위 내에서 EIS 측정을 사용하여 특성화되었다. 일반적으로 고주파 영역에서 반원 직경이 작을수록 Rct가 더 낮음을 나타낸다.[24] NiFe-LDH의 황화 후 반원 지름이 크게 감소하여 Rct 의 감소를 나타냈다(Fig. 11).

1.0M KOH 및 0.5M NaCl을 포함하는 전해질에서 측정된 NiFe-LDH, NiFe-LDH-S350, NiFe-LDH-S400 및 NiFe-LDH-S450의 EIS 결과.
따라서, 손쉬운 전하 이동에 의해 니켈 철 수산화물의 황화물로의 변환은 촉진되고, 이에 따라 해수 산화에 대한 반응 동역학이 촉진된다.
샘플의 고유 촉매 활성을 평가하기 위해 TOF를 다음과 같이 계산했다.
여기서 j, A, F 및 Ns는 각각 특정 과전위에서의 전류 밀도(A cm−2), 샘플 면적(cm−2), 패러데이 상수(96,485 C mol−1) 및 활성 부위 농도(mol cm−2)이다.[26] OER에 대한 Ns를 추정하기 위해 산화 전류가 스캔 속도의 함수로 측정된 이전 연구를 참조했다. 피크 전류는 다음과 같이 기울기가 Ns로 표시되는 스캔 속도와 선형 관계를 가진다.
여기서 n은 전달된 전자의 수(n = 1), R은 이상 기체 상수(8.314 J mol−1 K−1), T는 절대 온도(K)다.[27]
Fig. 12는 다른 스캔 속도에서 측정된 LSV 곡선을 나타내고 삽입된 그림은 피크 전류를 나타낸다. 기울기는 Ni-LDH, NiFe-LDH 및 NiFe-LDH-S350에 대해 0.054, 0.476 및 0.585로 계산되었으며 active sites는 각각 2.10×10−7 mol cm−2, 2.38×10−7 mol cm−2, 9.55×10−8 mol cm−2, and 1.41×10−7 mol cm−2 로 계산되었다.
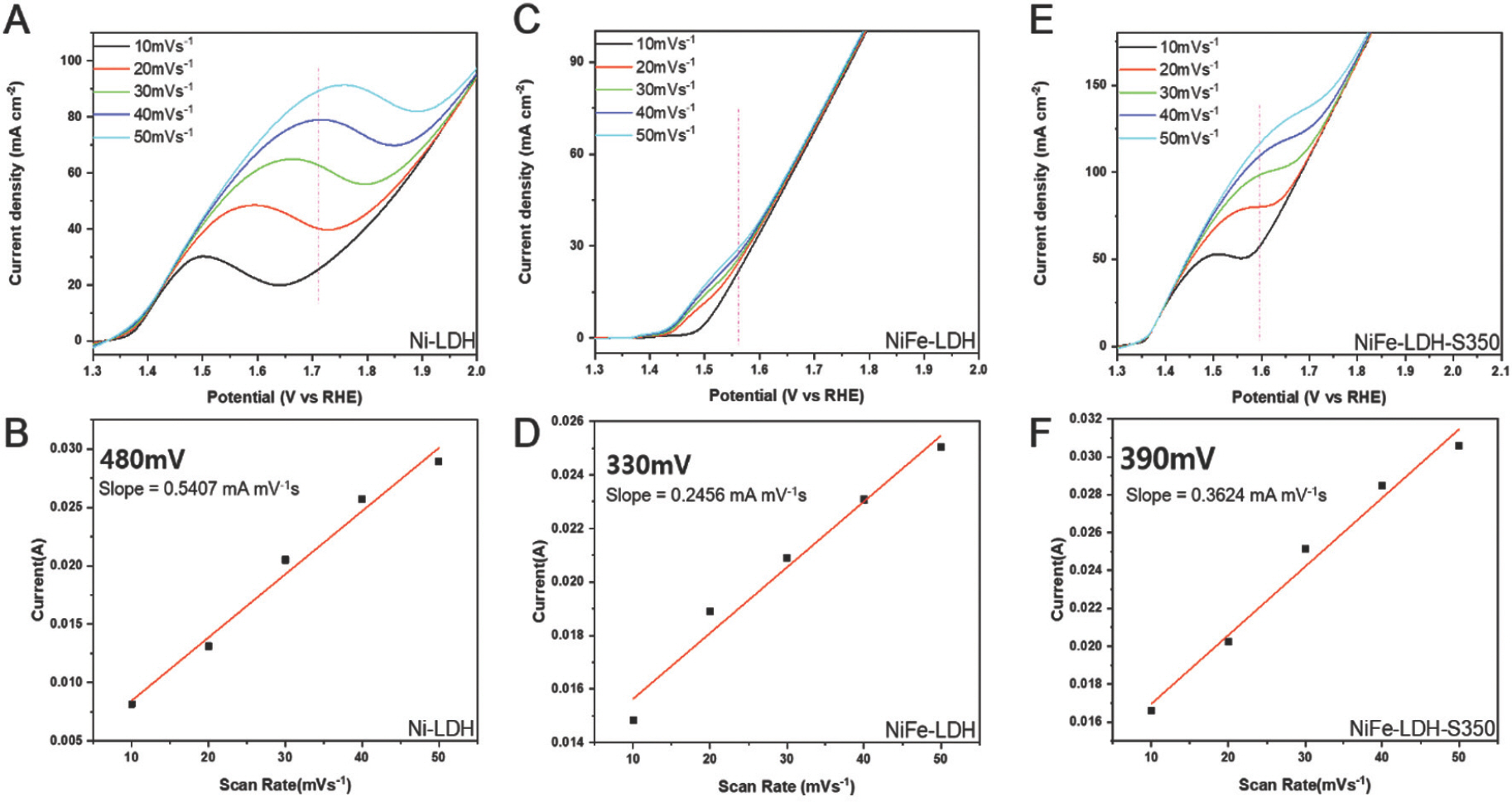
(a, c, e) 1.0M KOH 및 0.5M NaCl을 포함하는 전해질에서 다른 스캔 속도로 측정된 Ni-LHD, NiFe-LDH 및 NiFe-LDH-S350의 LSV 곡선. (b, d, f) Ni-LHD, NiFe-LDH 및 NiFe-LDH-S350에 대한 특정 과전위에서의 스캔 속도와 관련하여 추출된 전류의 선형 플롯.
또한 샘플의 TOF는 370mV의 과전압에서 Ni-LDH, NiFe-LDH 및 NiFe-LDH-S350에 대해 0.005 s−1, 0.479 s−1, and 0.585 s−1로 계산되었다(Fig. 13a). 결과는 NiFe-LDH-S350이 다른 샘플보다 해수 산화에 대해 훨씬 더 높은 촉매 활성을 나타내는 것으로 나타 났다.

Ni-LDH, NiFe-LDH 및 NiFe-LDH-S350의 (a) TOF, (b) Ea, (c) Cdl, 및 (d) 해수산화에 대한 Ni-LDH, NiFe-LDH 및 NiFe-LDH-S350의 ECS-정규화된 LSV 곡선.
활성화 에너지는 고유한 물질 특성에 의존하기 때문에 OER에 대한 촉매의 고유 활성 평가에 중요한 매개변수다.[28] Arrhenius 방정식은 다음과 같이 OER에 대한 활성화 에너지를 결정하는 데 적용될 수 있다.
ik = Ae−W/RT
여기서 ik 와 W는 각각 주어진 과전위에서의 kinetic 전류와 전체 활성화 장벽이고, A, R, T는 각각 빈도 인자(pre-exponential factor), 이상 기체 상수, 온도이 다. 따라서 LSV polarization곡선은 Ni-LDH, NiFe-LDH 및 NiFe-LDH-S350의 활성화 에너지를 계산하기 위해 서로 다른 온도에서 측정되었다(Fig. 14).
온도가 상승함에 따라 과전위가 줄어든 것은 분명하다. 300mV의 과전위에서의 1/T에 대한 ln(i)의 아레니우스 그림은 기울기가 −W/R로 계산된 직선을 표시한다(Fig. 13b). 기울기를 사용하여 Ni-LDH, NiFe-LDH 및 NiFe-LDH-S350에 대한 활성화 에너지는 각각 53.29 kJ mol-1, 63.02 kJ mol-1 및 39.40 kJ mol-1로 계산되었다. 이를 통해 NiFe-LDH-S350은 다른 샘플보다 우수한 고유 촉매 활성을 보인다는 것을 알 수 있다.
마지막으로, Cdl을 사용하여 전기화학 표면적(ECSA)을 계산한 다음, Ni-LDH, NiFe-LDH, NiFe-LDH의 고유 촉매 활동을 비교하기 위해 기하학적 전극 영역 대신 ECSA를 사용하여 LSV 곡선을 정규화했다.[29–31] Cdl 을 계산하기 위해, 이전 연구에 따라 non-Faradaic 전위 창 내에서 CV 방법을 사용했다 (Fig. 15).[31–32]
또한 Cdl은 Ni-LDH, NiFe-LDH 및 NiFe-LDH-S350에 대해 각각 1.86 mF, 3.62 mF, 0.94 mF로 얻어졌다(Fig. 13c). 1cm2의 평평한 표면적의 특정 정전 용량이 일반적으로 40μF cm−2의 평균 값을 갖는다고 가정했을 때, Ni-LDH, NiFe-LDH 및 NiFe-LDH-S350에 해당하는 ECSA는 각각 46.5cm2, 90.5cm2, 23.5cm2였다. Fig. 13d 는 해수 산화에 대한 촉매의 ECSA에 의해 정규화 된 polarization곡선을 나타내며, 또한 NiFe-LDH-S350이 다른 샘플에 비해 상당히 우수한 촉매 활성을 보였다. 특히 10 mA cmECSA −2의 전류 밀도를 생성하기 위해서는 330 mV의 과전위가 필요하여 해수에서 OER에 대한 고유 촉매 활성이 높았다.
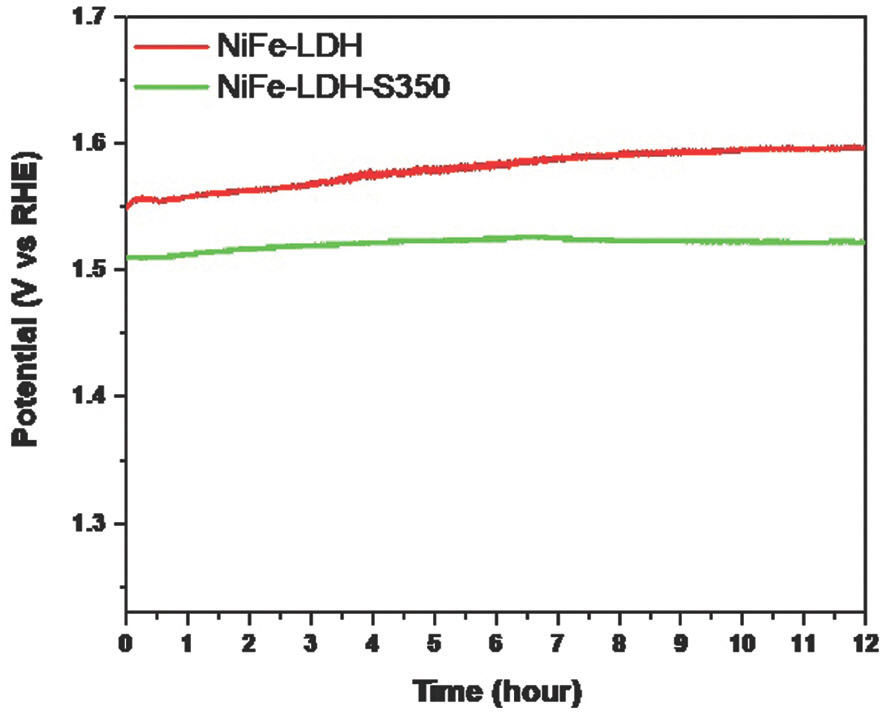
전기 촉매 안정성은 해수 산화에서 매우 중요한데, 알칼리성 전기 분해에 비해 부식상태가 더 증가되기 때문이다. 따라서 시뮬레이션 된 해수 전해액에서 100 mA cm−2의 일정한 전류 밀도에서 CP(chronopotentiometry)를 측정하여 NiFe-LDH-350에 대해 장기 안정성 테스트를 수행했다. 비교를 위해 NiFe-LDH는 동일한 조건에서 테스트되었다. 12시간 동안 연속 CP를 수행한 후, NiFe-LDH는 적용된 초기 전위에 비해 2.7%의 전위 증가를 보인 반면, NiFe-LDH-S350의 경우 전위는 0.7%만 증가했을 뿐이다(Fig. 16).
이는 NiFe-LDH-S350이 해수 산화에 우수한 촉매 안정성을 제공한다는 것을 의미한다. 또한 ex situ TEM 및 XPS 기술을 사용하여 장기간 해수 산화 후 NiFe-LDH-S350의 구조 및 화학적 변화를 조사하여 높은 전기 촉매 견고성을 확인했다.
Fig. 17은 post-OER NiFe-LDH-S350의 TEM 이미지를 나타낸다. 뚜렷한 2D 나노 시트 형태는 CP 이후에도 보존되었다. 또한 SAED 및 HR-TEM 이미지에서 보는 바와 같이 다결정질 특성이 확인되었다. NiFe-LDH 상의 (110)에 해당하는 0.154 nm의 면간 거리를 갖는 투명한 격자 무늬가 OER 후 샘플에서 관찰되었다. 또한 TEM을 사용한 EDS는 post-OER NiFe-LDH-S350에서 수행되었다(Fig. 18).

1.0M KOH 및 0.5M NaCl을 포함하는 전해질에서 100 mA cm−2에서 12시간 동안의 CP 후 NiFe-LDH-S350의 (a-b) TEM 및 (c) HR-TEM 이미지.
황의 농도는 기존 샘플(~0.42 at%)에 비해 CP 이후 샘플(~0.14 at%)을 관찰했을 때 상당히 감소되었다는 점을 유의해야 한다. 대조적으로, 산소 함량은 OER 후 12.85%에서 65.96%로 유의하게 증가하였다. 이는 KOH 전해질에서 발생한 해수 산화 과정에서 여러 황 원자가 산소 원자로 치환되어 표면에 황화물이 형성되었음을 나타낸다.
XPS 데이터는 OER 이후 NiFe-LDH-S350의 Ni 및 Fe가 2+와 3+의 혼합 원자가 상태를 나타냄을 보여주었다(Fig. 19a-b).[21] 황의 XPS 스펙트럼은 168.23 eV의 결합 에너지에서 명확하게 관찰되었으며, 따라서 OER 후 샘플에서 M-O-S 종의 존재를 나타냈다(Fig. 19c). 이것은 결합된 황 원자가 NiFe-LDH 매트릭스에서 황산화물로 변환되어 해수 산화에 대한 높은 전기 촉매 성능을 초래한다는 가설을 뒷받침한다.
4 결론
황을 NF-LDH에 포함시키면 해수에서 OER에 대한 전기 촉매 활성과 안정성을 크게 향상시킬 수 있다. 또한 NiFe-LDH-S350은 NiFe-LDH 와 황산염이 혼합된 복잡한 2차원 나노 시트 구조를 나타냈고, NiFe-LDH-S350은 순수한 NiFe-LDH와 귀금속에 비해 우수한 전기 촉매 활성과 안정성을 보였다. 시뮬레이션 된 해수 전해질에서 IrO2 와 같은 기반 촉매, 특히 NiFe-LDH-S350 은 해수 산화에 대한 강력한 촉매 안정성과 함께 100mA cm−2의 전류 밀도를 실현하기 위해 296mV의 과전위가 필요했다. 또한, TOF, Ea 및 ECSA 정규화 된 LSV 데이터는 NiFe-LDH-S350의 우수 한 고유 전기 촉매 특성을 확인했으며, 따라서 해수 수전해를 위한 고성능 전기 촉매 설계에 적합한 전략으로 NiFe-LDH에 황이 포함되어 있음을 확인했다.
References
Biography

◉◉한 혁 수
◉ 2014년 U. Florida 재료공학과 박사
◉ 2015년 한국생산기술연구원 선임연구원
◉ 2019년 홍익대학교 재료공학과 조교수
◉ 2020년 건국대학교 미래에너지공학과 조교수

◉◉정 선 영
◉ 2021년 한국교통대학교 응용화학에너지공학부 학사
◉ 2021년 건국대학교 미래에너지공학과 석사 과정