다공성 금속 구조체 합성 및 에너지 저장 소재로서의 응용
Synthesis of Porous Metallic Structure and Its Application for Energy Storage Materials
Article information
Trans Abstract
Porous metal or metal oxide frameworks have been comprehensively applicated to numerous fields such as catalyst, energy storage system, and bio-filtration. Here, we introduce a de-alloying method prior to a facile polymer gel-templating to synthesize a self-supporting porous metal/metal oxide frameworks (e.g. Au, Ag, Ag/CuO, Au/MnO2, etc.). The template methods based on polymer gel suggest easy preparation of porous metal/metal oxide frameworks, prepared by heating a metal precursor impregnated in polymer gel. Compared to de-alloying Ag65 A35 method, polymer gel based soft template serves numerous advantages as follows; 1) facile fabrication of porous transition metal structure, 2) atom economy, 3) high-loading of precious metals, 4) harmless to human and environment, 5) natural abundance, 6) easy to scale-up and control the pore size by differentiate the polymer content ratio, 7) mild reaction conditions, and 8) structural controllability, 9) cost-effectiveness, etc. We report the methodologies to synthesis bicontinuous metal/metal oxide architectures, derived from porous gel soft templates, and they are applicated to the energy storage system such as, supercapacitor, pseudocapacitor, and battery.
1. 서론
넓은 비표면적을 갖는 다공성 금속 또는 금속 산화물 구조체는 에너지저장장치, 촉매, 센서, 방열, 필터 등 다양한 산업분야에서 활용되고 있다.[1–4] 본 고에서는 에너지저장장치 시스템에 적합한 다공성 금속 및 금속 산화물을 제조하는 방식과 응용사례에 대한 고찰을 제시하고자 한다. 전지 내에서 이온 및 전자 수송에 관여하는 동역학적 특성을 향상시키기 위해서는, 이온확산계수가 높은 전극 재료를 설계하거나, 전도성 물질로 활물질을 코팅하는 등의 방식이 있다.[5] 또한, 전자와 이온 이동 경로가 3차원적으로 연결된 전극 구조체를 제조함으로써, 효율적으로 이온과 전자를 수송할 수 있다.[6–7] 3차원 다공성 금속 구조체는 우수한 기계적 강도와 높은 전기전도도를 갖기 때문에 동역학적 특성 향상을 위한 우수한 후보 물질이다. 다공성 금속 및 금속 산화물 구조체의 합성 방식은 chemical vapor deposition (CVD),[8] wet casting/coating,[9] Inkjet printing,[10] 탈합금화 방법[11] 등 다양한 방식이 존재하지만, 값비싼 장비를 사용하지 않으면서 손쉽게 scale-up이 가능하고, 다양한 form factor를 부여할 수 있는 방식은 대표적으로 고분자 기반 연성 주형법이 있다.
다공성 금속 구조체의 형태, 즉 기공의 크기, 깊이, 전체적인 기공도 및 기공 표면은 제작 기술에 따라 크게 달라지며, 다공성 금속 또는 금속 산화물 구조체 제조를 위해 사용되는 주형은 다음과 같은 요구 조건을 충족시켜야 한다. 1. 내부 기공이 유기적으로 연결되어 있어야 하고, 2. 금속이온 전구체와 화학반응을 일으키지 않아야 하며, 3. 주형 내부에 금속이온을 효과적으로 침투시키기 위해 겔의 기공 내부에 적절한 표면 특성을 가져야 한다.
주형(template)의 재료로는 경석(pumice), 산화 알루미늄(alumina), 실리카(silica) 등의 무기물이 주로 활용되어 왔다. 고분자로 이루어진 연성 겔은 불규칙한 배열로 인해 주형 제작 시 불균일한 기공형성 및 재현성 유지에 한계를 지니기 때문에 겔을 주형으로 활용하여 순수하게 금속으로만 이루어진 구조체를 합성한 예는 매우 드물다. 용이한 가공 특성, 높은 금속 함유량 등을 만족시키는 혁신적이고 경제적인 합성 방식의 개발은 산업계와 학계에 필수적이다. 이에 온화한 반응 조건과 단순한 제조공정으로 기공 사이즈를 효과적으로 조절하고 에너지 저장시스템에 응용하여 높은 성능을 보인 선행 연구 사례에 대해 소개함으로써 연성 주형 물질 개발을 위한 가이드라인을 제시하고자 한다.
2. 토의
2.1 탈합금화법
나노 다공성 구조를 형성하는 방법 중 하나로 탈합금화법이 있다. 탈합금화 공정은 2원계 합금으로부터 용출하기 쉬운 성분을 제거하는 방식으로 금, 백금, 팔라듐과 같은 귀금속 재료를 기반으로 한 나노 다공성 금속 제조에 용이하다. Chen 그룹은 2원계 합금인 Ag65 A35를 70% HNO3 용액에 담지하여 선택적으로 은(Ag)을 탈합금화 함으로써 전기 전도성이 높은 나노 다공성 금(Au) 구조체를 제작하였다.[11] 뒤이어 다공성 금(Au) 구조체에 MnO2 세라믹을 도금하여 나노 다공성 금속-세라믹 복합 박막(Au-MnO2 film)을 형성하였다(Fig. 1(a)). 에너지저장시스템 분야에서, MnO2는 pseudocapacitive 반응을 일으켜 용량을 향상시키는 물질로 알려져 있다. 전극 표면 내 흡/탈착을 이용하는 전기이중층 커패시터(electrical double-layer capacitor, EDLC) 전극보다 용량을 증가시킬 수 있지만 전기전도도가 10−5–10−6 S cm−1 정도로 낮아 율속 특성이 저조한 문제를 갖고 있다. 다공성 금(Ag)-MnO2 복합체의 경우 전기전도성이 높은 금(Au)을 집전체로 활용하여 율속 특성을 극대화시킬 수 있었다. MnO2를 도금하는 방식은 다음과 같다. 다공성 금(Au) 구조에 남아있는 산을 증류수로 세척한 후, 2 mM KMnO4와 5 mM KOH, hydrazine (N2 H4)기체를 밀폐 용기에 주입하여 환원 분위기를 형성한다. 형성된 조건에서 도금 시간을 조절하면 다공성 금 구조의 골격 표면에 로딩되는 MnO2 양을 제어할 수 있다. 나노 다공성 금(Au)은 Fig. 1(b)에 나타낸 바와 같이 ~40 nm의 나노 다공성 채널을 가진다. Fig. 1(c-e)에 나타낸 바와 같이 나노 다공성 금(Au) 내부에 5 nm 크기의 나노결정질 MnO2가 도금된다. 나노 결정질의 MnO2는 금(Au)의 표면에 수직 배향으로 성장한다(Fig. 1(e-f)). EELS 분석을 통해 Au 표면에서 MnO2로 전하 전달이 용이하여 MnO2의 L2,3 피크의 에너지가 낮아짐을 알 수 있다(Fig. 1(g)). 도금 시간(5, 10, 20, 30분)이 늘어남에 따라 MnO2 로딩양이 증가되어 전극 내 흐르는 전류 및 커패시턴스가 향상된다. 그러나, 도금시간이 20분을 초과하는 경우, 과량의 MnO2가 나노 다공성 금(Au)의 미세기공을 막아, 나노결정질의 MnO2와 전해질 사이의 효율적인 접촉을 방해하기 때문에 커패시턴스 및 전류 밀도가 감소한다(Fig. 1(h- k)). 실제 나노 다공성 금(Au)-MnO2 복합 박막 셀의 성능 평가 결과, 50 mV s−1 주사속도(scan rate)에서 MnO2의 이론적 용량(1,370 F g−1)에 근접한 ~1,145 F g−1을 구현하였다(Fig. 1(m)). 이는 나노 다공성 금(Au) 구조에 MnO2를 도금함으로써 MnO2 전반에 걸쳐 이온과 전하 확산 속도를 높였을 뿐 아니라 Au와 MnO2 계면 간 접착력을 개선하였기 때문이다. 전기전도도가 뛰어난 금(Au) 소재를 탈합금화법을 이용해 나노 다공성 구조를 형성함으로써 전기전도도가 낮은 MnO2 가 겪는 율속 특성 문제를 해결하였으며, 셀의 내부저항 또한 현 격히 감소시켜 전극의 활성을 극대화하였다.
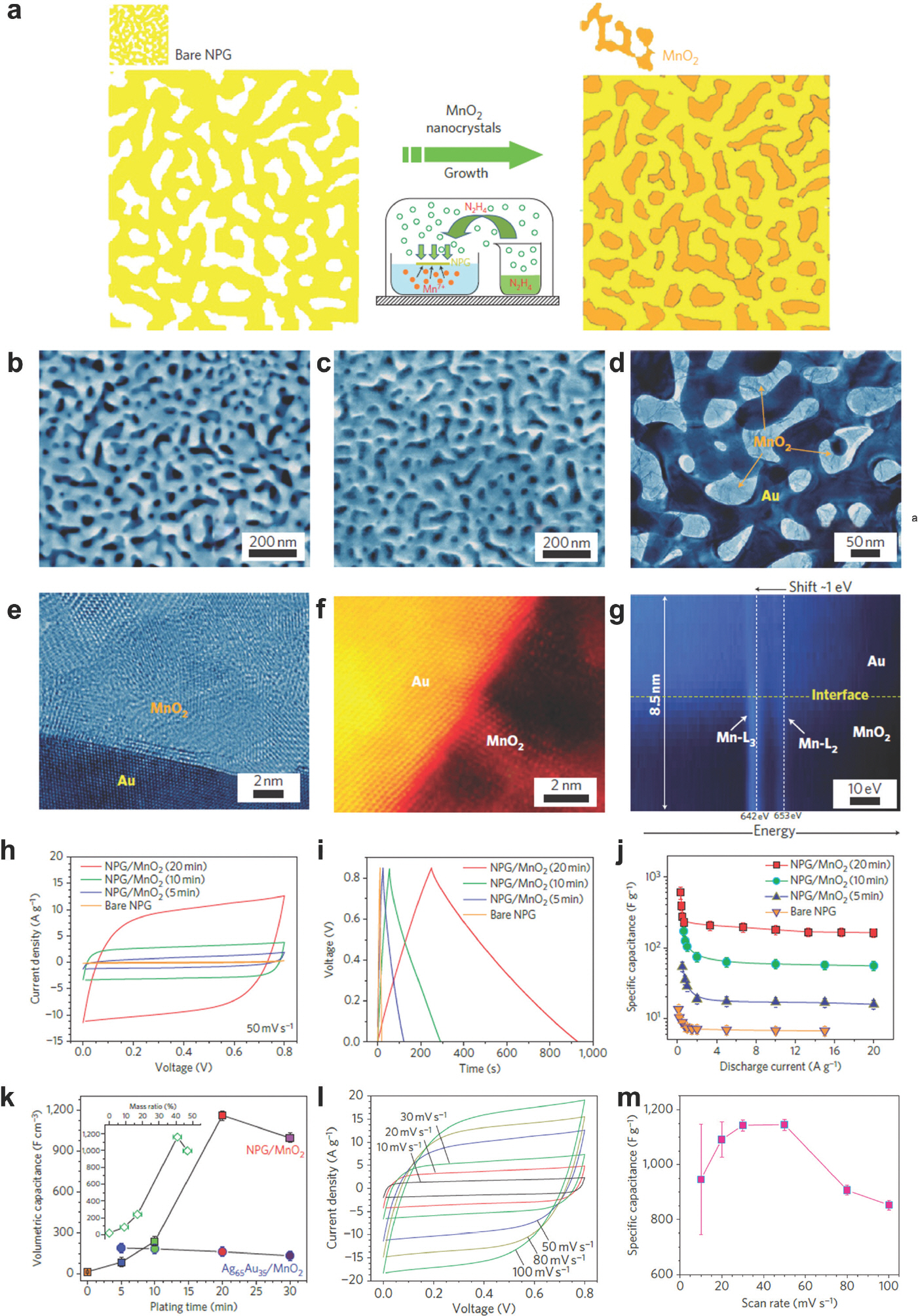
(a) 나노 다공성 금속-세라믹 복합 박막 (Au-MnO2 film) 제조 과정, (b) 나노 다공성 금(Au) 구조, (c) MnO2 10분 증착 후 Au-MnO2 film, (d) MnO2 20 분 증착 후 Au-MnO2 film TEM 이미지(밝은 부분: MnO2, 어두운 부분: 금(Au) 골격), (e) HRTEM 분석으로 확인한 금 표면 위에 증착 된 5 nm 크기의 MnO2, (f) HAAD STEM 분석으로 금(Au) 표면에 화학적 결합을 통해 수직적으로 성장한 MnO2 이미지, (g) EELS 분석으로 확인한 금(Au)과 MnO2 계면에서 형성된 MnO2 L2,3의 에너지, (h) 동일한 주사속도 내 도금 시간에 따른 순환전압전류그래프(cyclic voltammetry, CV), (i-j). 0.5 A g−1 전류밀도 내 도금 시간에 따른 충·방전 그래프, (k) 20분 도금한 Au-MnO2 film의 주사속도에 따른 CV 그래프, (l) 도금 시간에 따라 나타난 Au-MnO2 film과 Ag65 Au35-MnO2 film의 단위부피당 용량 변화, (m) 주사속도에 따른 용량 변화. Reproduced from Lang et al. Nature nanotechnology. 2011;6:232-236, with permission of Springer Nature Publishing.[11]
탈합금화 공정은 귀금속 외에 화학적 안정성이 낮은 철, 니켈, 코발트 타이타늄 등과 같은 전이 금속의 다공성 구조를 제작하는데 어려움이 있으며, 대용량으로 scale up 제작이 힘든 공정이다. 반면. 자연계 고분자는 인체에 무해하고, 친환경적이며, 자원이 풍부할 뿐 아니라 물에 쉽게 용해되어 수화된 겔을 형성하기 때문에 전기화학, 촉매, 필터 등 다양한 분야에 접목되어 활발히 연구되고 있다. 고분자 겔을 연성주형(soft template)으로 활용하여 다공성 금속 구조체를 제작할 경우 다음과 같은 장점을 갖는다. 첫 번째, 고분자의 함량비를 조절함으로써 목적에 부합하는 기공 크기를 부여할 수 있다.[12] 두 번째, 겔화(gelation) 과정에서 가공이 용이하여 원하는 모양으로 제작할 수 있기 때문에 향후 공정의 표준화 측면에서 유리하다. 세 번째, 친수성 작용기로 이루어진 고분자를 사용할 경우, 물에 쉽게 용해되어 수화된 겔 형태를 구성해서 금속 함유량을 증가시킬 수 있다. 본 고에서는 아가로스(agarose), 덱스트란(dextran), 폴리스타이렌(polystyrene)을 주형으로 이용한 다공성 금속 구조체 제조 방식을 알아보고, 에너지저장시스템 분야로의 응용 가능성을 설명하고자 한다.
2.2 고분자 기반 연성 주형법
2.2.1 아가로스 겔(agarose gel)
아가로스 겔은 홍조류인 우뭇가사리의 세포벽에서 추출한 다당류 복합체를 뜻하며, 한천(agar)과 같은 겔라틴 물질로서 식품, 의약품, 화장품 제조 등에 널리 활용되고 있다.[13, 14] 삼차원 금속 구조체를 합성하기 위한 연성 주형으로서 아가로스 겔의 구조적 특성과 물리화학적 장점은 다음과 같다. 아가로스는 D-galactose 와 3,6-anhydro-L-galactopyranose가 α-(1→3) 그리고 β-(1→4) 글리코시드 결합을 하고 있는 안정적인 화학구조를 갖는다.[15] 그로 인해 90-95 ℃ 수준의 높은 온도에서 수용액에 용해 및 겔화(gelation)되기 때문에 이후에 고농도의 금속 전구체가 수화된 기공 내부로 쉽게 침투하여 기공 내부에 금속 구조체를 효과적으로 형성시킬 수 있다. 아가로스 겔 고분자에 포함된 알데히드(aldehyde) 기능기는 적절한 환원성(reducibility)을 갖고 있기 때문에 기공에 침투한 금속 전구체가 공간적으로 분리된 채로 균일하게 환원되어 금속 클러스터(cluster)를 형성(nucleation)할 수 있다.[14]
아가로스 겔을 이용하여 다공성 금(Au) 구조체를 생성한 예가 있으며 제조 방법은 다음과 같다.[16] 아가로스 겔로 이루어진 연성주형에 금(Au)의 전구체인 HAuCl4를 모세관 현상(capillary action)을 이용해 친수성 기공 내부로 침투시킨다. 이후 NaBH4 환원제를 이용하여 기공 내부에 존재하는 금(Au) 이온을 완전히 환원시킨다. 세척하여 건조시킨 금(Au)-아가로스 겔 복합체를 5시간 동안 소성(air calcination)한다 (Fig. 2(a)). 소성과정에서 금(Au) 입자는 소결(sintering)되고, 180-550 ℃ 사이에서 아가로스 겔이 완전 분해되어 삼차원 금 (Au) 네트워크가 제조된다(Fig. 2(b)). 200 ℃에서 5시간 동안 소성하였을 때 아가로스 겔 매트릭스 본질의 기공성이 최대한 반영된 복연속성(bicontinuous) 금(Au) 구조체가 형성된다(Fig. 2(c)). 위 반응 조건에서는 약 200 nm의 직경을 갖는 서브 마이크로미터(sub-μm) 수준의 금(Au) 네트워크가 생성된 반면, 300 ℃의 온도 조건에서 소성 시 다공성 금(Au) 구조체 내에는 성긴 (sparse) 구조와 밀집된(dense) 구조가 모두 발견된다 (Fig. 2(d) and (h-i)). 500 ℃ 이상의 고온 조건에서 소성된 경우, 금(Au) 나노 입자가 심각하게 소결되어 반죽과 같은 형태가 나타나며 기공성이 사라진다(Fig. 2(e- g)). 이는 200-300 ℃ 조건에서 아가로스 겔의 분해속도 보다 금(Au) 나노 입자의 소결과정이 빨라지는 속도 추월 지점이 존재한다는 것을 의미한다. 아가로스 겔 주형법의 주요 장점은 다공성 금속 구조체의 크기 및 밀도를 자유롭게 조절할 수 있다는 것이다. 아가로스 겔 제조의 첫 단계인 겔화(gelation) 과정에서 아가로스의 농도를 증가시키면 연성 주형인 아가로스의 기공성을 조절할 수 있고, 이를 통해 제조되는 다공성 금(Au) 구조체의 기공 크기를 증가시킬 수 있다.[17]

(a) 아가로스 매트릭스를 활용한 다공성 금(Au) 구조체 합성 절차 모식도, (b) 아가로스-금(Au) 복합체의 점진적인 중량 감소를 보여주는 TGA 곡선, (c) 200, (d) 300, (e) 500, (f) 700, (g) 800˚C에서 소성한 금(Au) 구조체의 SEM 이미지 (모든 스케일 지표는 5μm), (h) 300°C에서 5시간 소성한 금(Au) 구조체의 SEM 이미지 (스케일 지표 10μm) 및, (i) EDS line scanning 결과. Reproduced from Kwak et al. Scripta Mater. 2021;196:113769, with permission of Elsevier Ltd.[16]
건조된 금(Au)-아가로스 겔 복합체를 비활성 기체(Ar, N2) 조건 하에서 탄화(carbonization) 시킬 경우 아가로스 겔이 탄소 전극물질로 전환되어 삼차원 다공성 금(Au)-탄소 하이브리드 구조체가 생성된다(Fig. 3(a)). 즉, 아가로스 겔을 다공성 금속 구조체 제작을 위한 연성 주형(soft template) 및 전극 소재인 탄소 전구체로써 동시에 활용해 에너지저장시스템 중, 슈퍼커패시터 전극소재로서의 활용성이 입증되었다.[18] 슈퍼커패시터는 고속 충·방전이 가능하고 높은 출력(power)을 공급할 수 있기 때문에 주요 에너지 저장시스템의 한 종류로 평가받고 있다. 활성탄과 같은 다공성 탄소 소재가 EDLC의 대표적인 전극물질로서 활용되고 있고, 전극물질 내 이온 확산 및 전자 전달 속도가 슈퍼커패시터의 출력을 결정짓는 중요한 변수이다. 아가로스 겔을 활용해 제작한 다공성 금(Au)-탄소 구조체는 탄소 전극소재의 전자 전달 속도를 획기적으로 개선할 수 있다.

(a) 금속-탄소 복합체의 제조 과정 모식도. 합성된 금(Au)-탄소 복합체의 (b) SEM, 및 (c) TEM 이미지, (d) 소성 과정으로 탄소가 제거된 금(Au) 구조체의 SEM 이미지. (e-g) 다양한 주사속도에서 금(Au)-탄소 (e), 활성탄 (f), 흑연 (g) 전극의 CV 그래프. (h) 금(Au)-탄소 복합체, 흑연, 활성탄의 Nyquist 임피던스 그래프, (i) 다양한 주사 속도 에서의 용량 변화, (j) 200 V s−1 주사속도에서 1백만 회 충·방전 과정 동안의 용량 변화 그래프 (금(Au)-탄소 복합체). Reproduced from Park et al. Chem. Commun. 2013;49:1554-1556, with permission of RSC Publishing.[18]
2 w/v %의 아가로스 겔 용액을 사용하여 다공성 금(Au)-아가로스 복합체를 제조한 뒤, 800 ℃에서 4시간 동안 비활성 기체(Ar) 분위기에서 탄화 과정을 거쳐 금(Au)-탄소 복합체를 제작한 후 슈퍼커패시터 전극으로 활용하였다. Fig. 3(b, c)의 SEM, TEM 이미지는 탄화 과정을 통해 제작된 다공성 금(Au)-탄소 복합체의 구조를 나타낸다. 소성 과정을 통해 아가로스 겔 주형을 제거한 다공성 금(Au) 구조체(Fig. 3(d))와는 달리 탄소 소재가 다공성 금(Au)과 복합체를 형성하고 있다는 것을 확인할 수 있다. Fig. 3(e)는 다공성 금(Au)-탄소 복합체를 슈퍼커패시터 전극 소재로 활용하였을 때 전기화학 성능의 평가 결과이다. 비교를 위해 활성탄과 흑연을 전극 소재로 제작하여 전기화학 성능평가를 진행하였다(Fig. 3(f) and (g)). 다양한 주사속도 조건에서 순환전압전류법을 통해 평가한 결과를 살펴보면, 금(Au)-탄소 복합체의 경우 1,000 V s−1에 이르는 초고속의 충방전 상황에서도 대칭적이고 사각형 모양의 CV 커브를 나타내어 바람직한 커패시턴스 특성을 보인다. 이는 초당 625회 충·방전이 가능함을 의미한다. 반면, 활성탄은 0.5 V s−1의 낮은 스캔속도에도 높은 저항으로 인해 커패시터로서의 거동을 보이지 않는다. 흑연은 다공성 금(Au)-탄소 복합체와 동일한 25 V s−1의 스캔속도에서 전기화학적 거동을 살펴보았을 때 충·방전 계형의 대칭성이 무너지면서 용량이 현격이 감소한다. 에너지 효율 측면에서도 다공성 금(Au)-탄소 복합체가 활성탄이나 흑연과 같은 기존의 탄소소재보다 우수함을 Fig. 3(i)를 통해 알 수 있다. 또한, 1백만회의 가혹한 충·방전 조건에서도 100 %에 가까운 충방전 효율 뿐만 아니라 안정적인 커패시턴스를 유지하였다(Fig. 3(j)). 아가로스 겔을 통해 생성된 복합체는 두 물질 사이의 이격이 작아 계면저항이 매우 낮으며, 화학결합이 발생하지 않아 구조가 안정적으로 유지된다. 이와 같은 특성으로 인해 에너지저장장치로 사용되었을 경우, 슈퍼캐퍼시터 전극으로 흔히 사용되는 활성탄이나 흑연보다 장시간 우수한 성능을 보인다.
2.2.2 덱스트란 겔(Dextran gel)
덱스트란은 다음과 같은 이유로 다공성 금속 및 금속산화물 구조체 합성을 위한 연성주형으로서 우수한 특성을 갖는다. 첫 번째, 덱스트란은 알파-1,6-결합이 지배적인 D-글루코스로 구성되어 있으며, 녹말 및 셀룰로오스와는 달리 상온에서 높은 수용성을 갖는다. 금속염이 농축된 수용액에 덱스트란을 용해시킬 경우, 금속 전구체가 고체 형태로 석출되기 전에 금속염을 다량 함유할 수 있다. 이로 인해 기존의 불용성 지지체가 갖는 낮은 금속 로딩 문제를 해결할 수 있다. 두 번째, 덱스트란은 환원성 알데하이드 관능기를 다량 함유하고 있기 때문에 금속 이온이 내부적으로 환원되어 복연소성 금속 구조체를 생성할 수 있다. 세 번째, 반응 조건이 까다롭지 않기 때문에 금, 산화구리, 은/산화구리 복합체의 거대 다공성 프레임워크로 쉽게 확장될 수 있다.[19] 덱스트란을 연성 주형으로 사용해 다공성 은(Ag) 구조체를 제조하는 방식은 다음과 같다. 은(Ag) 전구체인 질산은(AgNO3)이 농축된 용액에 덱스트란을 용해시켜 금속 전구체를 내부로 침투시킨다. 이 과정에서 환원성 알데하이드기로 인해 부분적인 은(Ag) 이온이 부분적으로 환원된다. 이후 520-900 ℃의 온도로 가열하여 유기성분이 제거하면, 연성주형의 내부 기공성을 반영한 은백색의 모노리스가 생성된다. 600 ℃에서 제조된 은(Ag) 구조체는 0.5 m2 g–1에 달하는 표면적을 가지며, 가열 온도가 증가함에 따라 표면적이 점진적으로 감소하는 양상을 띈다 (Fig. 4(a-e)). 이는 아가로스와 동일하게 소결 온도가 증가하면서 상호 연결된 입자가 성장하기 때문이다. 다공성 금속 구조체의 기공 크기는 덱스트란 농축액의 점도에 직접적인 영향을 받는다. 저점도 농축액을 사용할 경우, 금속 구조체 내부가 불완전하게 연결된 구조를 갖는 반면, 고점도 농축액과 반응한 경우 매우 밀집된 금속 구조체가 생성된다(Fig. 4(f-g)). Fig. 4(h)에 보이는 바와 같이, 질산은 용액과 구리 질산염을 단순 혼합하는 방식을 통해 다공성 은(Ag) 구조체에 산화구리 결정을 포함하는 금속 골격을 형성할 수 있다. 뿐만 아니라, 질산은 용액에 소량의 티타니아 나노 입자를 소량 첨가하여 은(Ag)/TiO2 복합 구조체를 생성시킬 수도 있다(Fig. 4(i)).

다른 온도에서 제조된 다공성 은(Ag) 구조체의 SEM 사진; (a) 600, (b) 700, (c) 800, (d) 900 ˚C, (e) BET 분석 장비로 측정된 은(Ag) 구조체의 표면적과 온도 의존성, (f) 저점도 질산은(AgNO3) 농축액을 사용하여 제조한 은(Ag) 구조체의 SEM 사진, (g) 고점도 질산은(AgNO3) 농축액을 사용하여 제조한 은(Ag) 구조체의 SEM 사진, (h) 800 ˚C에서 제조된 산화구리 입자가 올라간 은(Ag) 구조체의 SEM 이미지, (i) 600 ˚C에서 제조된 Fe2 O3 구조체의 SEM 이미지. Reproduced from Walsh et al. Nature Mater. 2003;2:386-390, with permission of Springer Nature Publishing.[19]
2.2.3 폴리스타이렌 겔(Polystyren gel)
폴리스타이렌은 Friedel-Crafts alkylation 반응을 통해 사슬을 촘촘하게 연결시켜 나노 구조체를 형성하기에 적합한 고분자이다. 나노 다공성 물질을 합성하는 방식으로 폴리스타이렌을 단독으로도 활용 가능하나, 블록공중합체를 전구체로 다공성 고분자를 제조하기도 한다. 블록공중합체는 서로 다른 성질의 고분자가 공유결합에 의해 연결된 형태로 블록공중합체를 구성하는 블록간의 조성과 사슬의 길이, 상호인력계수에 따라서 구, 실린더, 라멜라와 같은 기본적구조부터 자이로이드와 같이 복잡한 3차원의 나노 구조체로 자가 조립되는 능력을 갖고 있다.[20] 이 중 자이로이드 구조는 3D 공간에서 매트릭스와 두개의 연속 네트워크가 있는 고유한 질감으로 인해 매력적인 구조 중 하나로, 높은 다공성과 넓은 표면적 덕분에 에너지저장장치, 촉매, 하이브리드 태양전지 등 다양한 응용분야에서 사용하기에 유망한 물질이다. Hasegawa 연구팀은 Polystyrene-b-poly(l-lactide) (PS-PLLA) 물질을 활용하여 블록공중합체를 합성하였다.[21] PS 매트릭스 내 연속적인 PLLA 네트워크로 구성된 이중 자이로이드 상은 합성된 PS-PLLA 용액 주조 후에 형성이 가능하며 PLLA 네트워크는 가수분해 반응을 통해 선택적으로 제거될 수 있다. PS 주형 네트워크에 금속을 증착할 때 무전해 도금 공정을 이용하였다. 무전해 도금 공정은 용액 내 전류를 흘려 금속을 증착 시킬 필요가 없어 전도성 기판을 필요로 하지 않는 이점을 갖고 있다. PS 네트워크 내부에 금속을 환원시킬 수 있는 촉매를 형성하기 위해 Ethanol, HCl, PdCl2가 함유된 용액을 함침 시켰다. 함침 과정으로 PS 주형 내부에는 소량의 Pd 클러스터가 생성되고, 이는 전류의 공급 없이 Ni2+를 Ni로 환원시키는 촉매 작용을 한다. 자가 촉매 환원반응을 통해 수성 Ni 이온 용액에서 나노 다공성 PS 주형 구조가 Ni 로 채워질 때까지 반응은 지속적으로 일어난다. 이 후 Tetrahydrofuran (THF)를 사용하여 PS 매트릭스를 제거하면 자이로이드 Ni 금속을 얻을 수 있다. 이와 같이 블록공중합체 주형법을 이용하면 센티미터 크기의 샘플 내에도 크랙 없이 균일한 기공을 형성할 수 있다. 이는 대면적에서도 정밀하게 제어된 나노 다공성 구조 형성이 가능함을 의미한다. BET 분석을 통해 나노 다공성 자이로이드 Ni의 기공률은 62 %이며, Ni의 표면적은 1467 m2 mol−1로 넓은 표면적을 가진다. 합성된 자이로이드 형태의 Ni은 넓은 표면적과 3차원 나노 다공성 금속 구조를 가지므로 전극활성물질을 도금하면 새로운 에너지저장물질 소재로 활용 가능하다.
3차원 나노 구조를 갖는 전극은 리튬이온과 전하전달의 확산거리를 획기적으로 줄일 수 있어, 전기전도도가 낮은 물질도 고속 충·방전이 가능한 장점을 가지고 있다.[22] 그러나 일반적으로 중기공을 갖는 3차원 나노 구조의 경우, 이온의 확산 저하 문제는 해결이 가능하나, 전자 확산의 한계로 인해 물질 자체의 전도성이 낮아 배터리의 율속 특성이 급격하게 감소할 수 있다. 형성된 거대 기공성 주형에 미세기공을 추가 도입하여, 이중 나노 기공성 전극을 제작하면 전하전달 능력을 향상시킬 수 있다. 배터리의 양/음극에 높은 전기전도도를 제공하기 위해 자기 조립된 PS 콜로이드 주형을 활용하여, 3차원 나노 집전체를 형성하였다 (Fig. 5(a)).[23] 제작된 집전체는 NiMH 양극과, LiMnO2 양극에 활용하였다. PS 구의 크기를 조절함에 따라 리튬이온과 전하전달 확산거리를 조절할 수 있다. NiMH 양극의 경우, 1.8 um PS 구를 택하였다. 이와 달리 LiMnO2는 전기전도도 및 이온 전도도가 NiMH에 비해 더 낮기 때문에 비교적 짧은 고체상태 확산 길이를 생성하고자 466 nm PS 구를 활용하였다. 니켈 집전체의 제작방법은 Fig. 5(b)와 같이 PS 구를 증류수에 분산시켜 0.5 ~2 wt %의 현탁액을 준비하고, 실리콘 웨이퍼를 50-55 ℃ PS 현탁액에 넣으면 PS가 수직으로 증착 된다. 95 ℃에서 2시간 동안 소결 시킨 후, 0.5-1 M 농도의 에칭 용액에 전압 6V를 가해 니켈을 도포한다. Tetrahydrofuran (THF)으로 PS 주형을 제거 후 활물질을 바로 증착 하면 좁은 연결창으로 인해 활물질의 등각 증착을 막아 충·방전 속도가 제한되는 문제가 발생한다. 전해 연마 방식을 사용하여 거대기공을 갖는 니켈 집전체 내 인접한 PS 구의 연결된 pore의 생성으로 이중 나노 기공성 전극을 제작할 수 있다. 일반적으로 3차원 나노 전극의 경우 낮은 부피비를 가져 높은 에너지밀도를 갖기 어렵지만 본 논문에서는 전기화학적 식각방법을 이용해 부피대비 기공율을 74%에서 이론적인 값인 96.4%와 유사한 값인 94%까지 증가시켰다. 1.8 um PS 구와 466 nm PS 구를 사용하였을 때 전해 연마 방식으로 기공의 크기를 증대시킨 구조를 SEM 이미지로 확인하였다 (Fig. 5(c)).
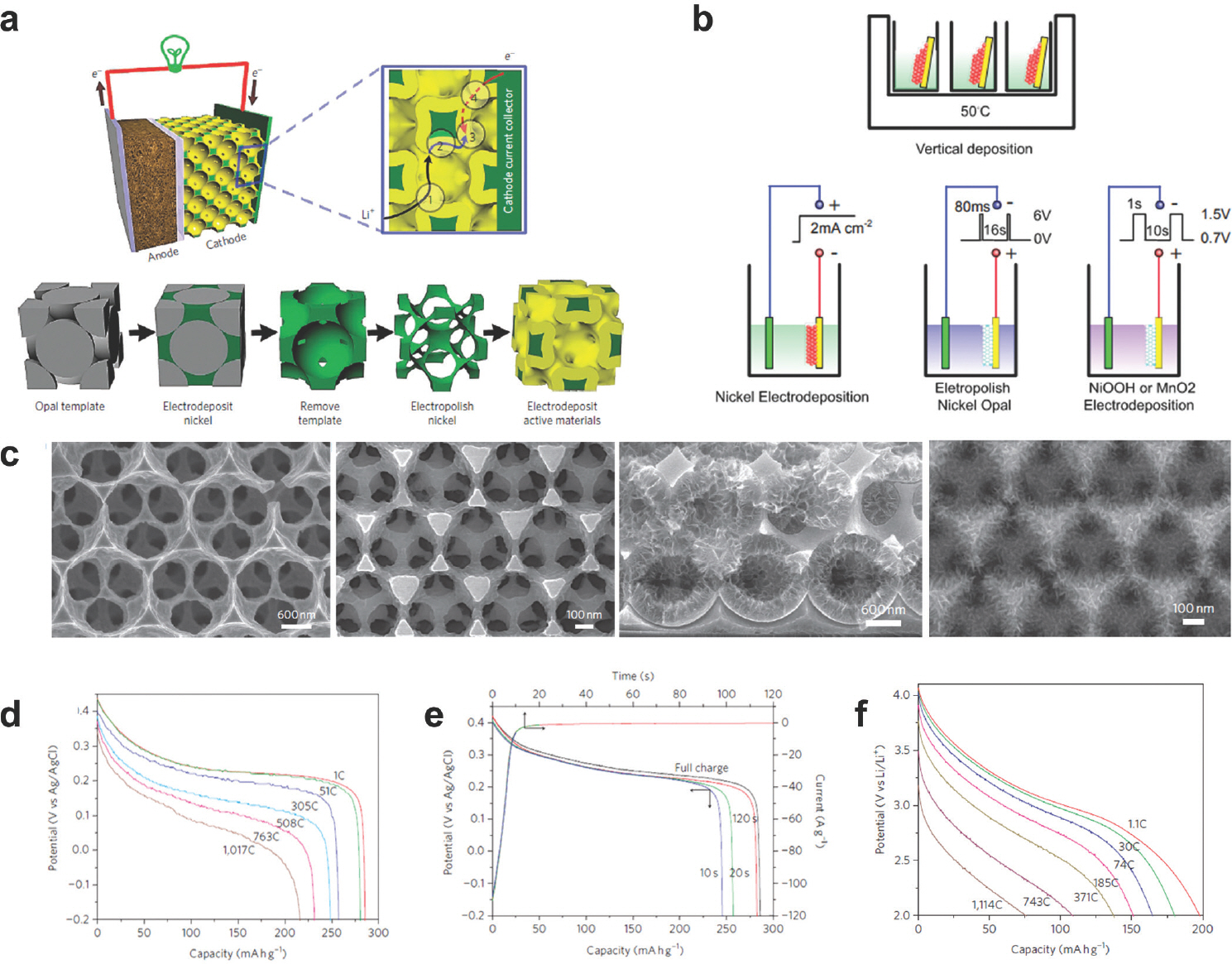
(a) PS를 주형으로 활용한 전극 제조 공정 (활물질: 노란색, 다공성 금속집전체: 녹색), (b) PS 수직 증착을 통한 주형 제작 및 니켈 증착 과정, (c) 전해 연마 후 1.8 um와 466 nm의 PS를 이용한 Ni 구조, NiOOH 양극 단면 이미지, MnO2 양극의 FE-SEM 이미지, (d) 다양한 율속 특성에서 NiOOH 양극 방전 그래프, (e) 일정전위 충전 시간에 따른 NiOOH의 방전 용량, (f) 여러 율속 특성에서 나타난 MnO2의 방전 그래프. Reproduced from Zhang et al. Nature Nanotechnology. 2011;6:277-281, with permission of Springer Nature Publishing.[23]
NiOOH 양극은 기준전극은 Ag/AgCl, 상대전극은 Pt foil을 사용하여 테스트를 진행하였다. 일반적인 50 um – 1 mm 기공크기로 이루어진 Ni 집전체에 NiOOH를 코팅한 경우, 전기화학적 성능테스트 시 C-rate 을 통한 전류밀도를 기준으로 35 C를 초과했을 때 기존 용량의 1~2% 가량 만이 구현 가능하다. 반면에 3D 주형을 통해 이온과 전하 전달의 확산거리를 줄인 Ni 집전체는 Fig. 6(d)에 나타낸 바와 같이 305 C에서 1 C 용량의 90%를 유지한다. 방전속도가 1,017 C로 증가하면 1 C 용량의 75%를 단 2.7 s 만에 구현 가능하였다. 또한 장수명 테스트 결과 6 C에서 100 사이클 구동 후에도 95 %의 용량을 유지하였으며 전극의 구조 또한 붕괴되지 않음이 SEM 이미지로 확인되었다.
LiMnO2는 LiNO3와 LiOH를 혼합하여 molten salt 반응을 통해 합성되었으며, NiOOH와 마찬가지로 고출력 상황에서도 높은 용량이 발현되었다. LiMnO2의 성능은 1 M LiClO4 (EC:DMC)전해질 조건에서 평가되었다. 185 C에서 방전 시 이론적 용량의 76% 구현이 가능했으며, 1,114 C로 구동 시 38%의 용량을 얻었다. 장수명 테스트 결과 3 C에서 50 사이클 구동 후 88% 용량을 유지하였다 (Fig 6(f)). 즉 전해 연마방식을 이용하면 주형의 중심 공극을 막지 않고 3차원의 이중 나노 기공성 전극합성이 가능하다. 이에 전하전달과 이온전달 속도가 향상되어 고에너지밀도와 고전력을 모두 구현할 수 있다.
3. 결론
다공성 금속 구조체는 독특한 기공 구조, 넓은 표면적, 높은 전기전도성을 지녀 슈퍼커패시터 및 리튬이온배터리와 같은 에너지저장 소재, 센서 및 촉매 등 광범위한 분야에 활용될 수 있다. 기존에는 다공성 금속 구조체를 제조하기 위해 탈합금화 방식을 이용했으며 안정성이 높은 귀금속 재료만 다공성 구조체로 제작할 수 있었다. 재료의 다양화가 어렵고, scale-up이 불가능한 기존 방식과 달리 본 고에서 소개한 고분자 기반 연성 주형법은 가공이 단순하고, 환경 친화적이며, 주형의 밀도 및 기공의 크기 조절이 용이하다. 또한 고분자 블록공중합체 형성 방식에 따라 구, 실린더, 라멜라, 자이로이드 등 3D 형태의 복연속성 구조 합성이 가능하다. 이와 같은 주형에 전극 활물질을 코팅함으로써 고에너지밀도 및 고출력이 가능한 새로운 에너지저장소재를 개발할 수 있다. 연성 주형법의 유용성을 향상시키기 위해 1) 고분자 주형에 증착되는 금속의 정량적 분석, 2) 넓은 비표면적 내 무전해 도금 공정에 대한 메커니즘 이해, 3) 고분자 재료의 분산도 및 크기, 모양과 같은 특성이 다공성 금속 구조체 형성에 미치는 영향 분석과 같은 연구가 이뤄진다면 고분자 연성 주형법은 응용 범위가 다양한 나노다공성 금속 및 금속산화물 재료 개발의 핵심 도구가 될 수 있을 것이다.
4. Acknowledgement
이 논문은 2022년도 한국기술교육대학교 교수 교육연구진흥과제 지원과 2020년도 정부(과학기술정보통신부)의 재원으로 한국연구재단의 지원을 받아 수행되었습니다 (NRF-2020R1C1C1005618).
References
Biography

◉◉장서현
◉ 2015~2019 서울여자대학교 화학과 학사
◉ 2020~현재 중앙대학교 지능형에너지산업융합학과 박사과정

◉◉강지현
◉ 2016~2019 서울여자대학교 화학과 학사
◉ 2019~현재 중앙대학교 지능형에너지산업융합학과 박사과정

◉◉박수민
◉ 2004~2010 연세대학교 생명공학과 학사
◉ 2010~2016 서울대학교 화학생물공학부 박사
◉ 2016~2019 로렌스버클리국립연구소 박사후연구원
◉ 2019~2022 삼성전자 삼성리서치연구소 Staff Engineer
◉ 2022~현재 한국기술교육대학교 에너지신소재화학공학부 조교수

◉◉남인호
◉ 2006~2010 연세대학교 화학공학과 학사
◉ 2010~2016 서울대학교 화학생물공학부 박사
◉ 2016~2018 스탠퍼드대학교 박사후연구원
◉ 2018~2019 서울여자대학교 조교수
◉ 2019~현재 중앙대학교 조,부교수