고농도 불소함유 산업폐수 처리를 위한 불화칼슘 결정화 최적조건 도출
Estimation of optimal conditions for crystallization of calcium fluoride for treatment of high-concentration fluorine-containing industrial wastewater
Article information
Trans Abstract
This study attempted to utilize fluidized bed reactor for fluoride removal and CaF2 purity from the industrial wastewater including high concentration of fluoride ion. Effects of HRT, pH, Ca2+ amount and seed height were investigated through lab-scale batch and continuous experiments. Considering fluoride removal efficiently and CaF2 purity that HRT 5hr, pH6, seed height of 50 cm, [Ca2+]/[F-](mol/mol) ratio of 0.55 were found to be optimum. Correspondingly, removal fluoride was 82.5%, with a CaF2 the crystallization rate of 95.1%, respectively. The results of continuous experiment showed that with pellet as CaF2, fluoride concentration can be stably reduced to less than 45mg/L in effluent from the influent 300mg/L on average. HR-XRD analysis showed that the crystalline structure of crystals was mainly CaF2.
1. 서론
불소 이온은 우리 나라를 수출 주도형 국가로 만든 핵심 사업인 반도체, 전기/전자 산업, 유리제조, 제철, LCD제조 산업 등 많은 산업분야에서 사용되어지고 있는 원소이며 폐수처리 시설에서의 고농도 불소이온의 배출은 주변 환경 및 실생활에서 사용되는 물을 오염시킬 수 있는 문제를 야기할 수가 있다. 불소 이온은 인체의 필수 원소 중 하나지만 5 mg/L을 초과하게 되면 치명적인 독성을 야기시켜 추후 골다공증, 관절염, 뇌 손상 등을 유발하여 건강에 큰 해를 끼칠 수 있으므로 산업폐수 내 불소 이온처리는 새로운 환경문제로 부각되고 있다.[1,2] 대표적인 고농도 불소를 함유한 폐수는 전기/전자 (300∼4,500 mg/L), 반도체 및 디스플레이 (400∼1,200 mg/L), 제철 (6,500∼130,000 mg/L) 관련 산업에서 배출되고 있으며 제조공정에 따라 발생되는 불소 농도는 다양하게 분포되어 있다. 특히 반도체 폐수는 대표적인 고농도 불소를 함유한 폐수 중 하나로, 반도체 산업은 최근 우리나라의 주요 수출 종목으로 앞으로 급격한 반도체 산업 성장과 함께 대량의 고농도 불소이온이 포함된 반도체 폐수의 발생이 예상된다.[3]
불소 이온 처리에 대한 연구는 오래전부터 진행되어지고 있었으며 대표적으로 소석회 응집/침전법, 희토류 흡착법, 이온교환법, 전기분해 등을 활용한 공법들이 연구되어 왔다.[4-7] 그 중 가장 일반적으로 사용되는 공법은 소석회 응집/침전법으로, 고농도 불소를 함유한 폐수를 대상으로 응집제로 Lime(Ca(OH)2)을 첨가하여 CaF2 응집 결정으로 생성한 후 무기 슬러지 형태로 처리하는 방법이다.[8] 이는 대량의 폐수를 짧은 체류시간으로 처리할 수 있고, 공정의 운전이 용이하다는 장점을 가지고 있다. 하지만 Lime의 용해도가 낮아 시간이 지날수록 반응성이 저하되고, CaF2 응집 형성을 방해하는 폐수 내 불순물로 인하여 처리효율이 낮아 대부분 PAC (Poly Aluminum Chloride), Alum 등 2단 공정으로 운영되고 있다.[9] 또한, 폐수처리 과정에서 배출되는 무기 슬러지는 응집제 및 폴리머와 원수에 함유된 중금속 성분의 불순물 함량이 높아 유가 자원으로 재활용이 힘든 것으로 알려져 있다. 현재 대부분 무기 슬러지는 시멘트 원료로 재활용되고 있는 상황이지만 국내 시멘트 공장 용량이 부족하여 향후 추가적으로 발생되는 무기 슬러지는 매립 처분이 불가피하므로 2차적인 토양오염의 문제가 우려되고 있다.[10] 따라서 고농도 불소폐수 내 불소 이온 처리와 동시에 불소 이온을 추출하여 유가자원으로 활용하는 기술의 개발이 필요하며, 이를 통해 환경 문제를 완화하면서도 불소 이온의 잠재적인 가치를 활용할 수 있다.
문헌 연구에 따르면 불소 이온을 유가자원으로 활용하기 위해 불화칼슘 (CaF2) 결정화 공법 연구가 진행되고 있으며, 이 기술은 기존의 화학적 응집/침전 공법을 대체할 수 있는 것으로 알려져 있으며, 배출되는 폐기물 발생량이 적고 고순도의 불화칼슘 결정을 생성할 수 있는 특징을 가지고 있다.[11,12] 결정화 반응 기작은 불화칼슘의 용해도와 과용해도 곡선 사이에 위치한 준안정구역 (Metastable Supersaturated Zone)에서 결정으로 석출되는 종결정 (Seed material)의 표면 위에서 불화칼슘 결정이 성장하게 된다.[13,14] 이러한 기작은 미세결정의 자발적 생성 없이도 종결정을 중심으로 결정성분이 성장하여 용해도까지 불화칼슘 결정을 석출시키는 특징을 가진다. 불화칼슘 결정화 공법은 대부분의 불소 이온이 Seed 표면 위에 석출되어 응집/침전 공법과는 다르게 무기 슬러지 발생량이 거의 없으면서 고순도의 불화칼슘 결정을 생산할 수 있는 장점을 가지고 있다. 불화칼슘 결정화 공법은 적정 pH와 불소이온 농도 조건 하에서 식 (1)과 같이 불화칼슘 (Calcium fluoride) 형태의 난용해성염이 Seed 표면에 결정입자로 석출되며 용해도 식에 의해 불화칼슘의 용해도는 4.0 × 10-11 M이며, 이 때 이론적인 불소 농도는 5.13 mg/L이다.[15]
본 연구에서는 불화칼슘 결정화 기작을 활용하여 고농도 불소폐수내 불소 이온을 CaF2 결정 형태의 유가자원으로 재이용이 가능한 결정화 공법을 개발하고자 한다. 실험에는 수분 함량이 낮은 결정의 생성 가능하고 슬러지 처리에 필요한 공간이 필요하지 않는 Fluidized Bed Reactor(FBR) 반응기를 활용한다. FBR 반응기의 기본 원리는 반응기 내 Seed를 채운 후 상향류 흐름으로 유동시켜 폐수 내 불소 이온이 Seed에 자체 흡착 이후 결정 성장이 일어나 크기가 증가하는 고순도 결정을 형성한다. 또한, 결정 크기가 증가할수록 고액분리가 잘되어 처리수의 수질도 향상될 것으로 판단된다. 현재 불화칼슘 결정화에 관한 연구는 미비한 상태이며, 본 연구를 통해 불화칼슘 결정 재이용에 대한 가능성과 불소 이온 처리에 대한 기초자료를 제공하고자 한다.
2. 실험방법
2.1 폐수 성상 및 실험재료
본 연구에서는 고농도 불소 이온을 함유한 반도체 폐수의 성상과 유사하게 합성폐수를 제조하여 사용하였다. 폐수의 성상은 Table 1과 같으며, 불화칼슘 결정화 반응에 사용된 불소원과 칼슘원은 HF(Hydrofluoric acid), CaCl2(Calcium chloride) 약품이며, 그 외 미량원소는 Glucose, NH4 OH(Ammonium hydroxide), NaCl (Sodium chloride), Silicon dioxide, Tungsten powder를 사용하였다. pH는 1M NaOH와 1M H2SO4를 이용하여 조절하였고 Seed는 국내산 규사를 사용하였다.
2.2 실험 장치
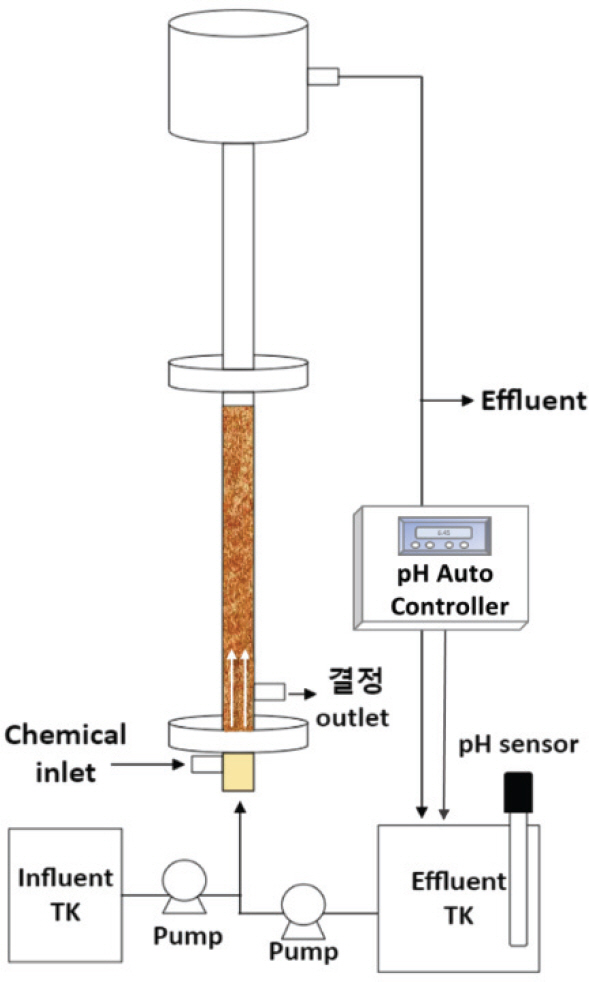
본 연구에서는 불소처리 및 불화칼슘 결정화를 위해 실험실 규모의 유동층 반응기 (Fluidized bed reactor, FBR)를 제작여 사용하였다 (Fig. 1). 반응기 내부의 상태를 시각적으로 관찰하기 위해 반응기는 아크릴 재질로 제작되었으며, FBR의 외경은 50 mm이며, 반응조 높이는 2,150 mm이다. 처리수 배출구는 상부 웨어 아래에서 150 mm아래 아래쪽에 위치하며, 자연유하에 의해 배출된다. CaCl2 약품 주입구는 반응기 하부에서 400 mm 위에 설치되었으며, CaF2 결정 배출구는 약품 주입구 지점 위에 설치되어 불화칼슘 결정을 인발할 수 있도록 구성하였다. 실험 장치는 체를 이용하여 직경을 0.3∼0.7 mm 내로 분류한 Seed를 채운 반응기 하부에서 인공폐수가 주입됨에 따라 Seed의 상하 유동이 가능하도록 상향류 식으로 운전하였으며, 반응기 내 Seed와 유입수가 접촉하는 위치에서 CaCl2을 주입하여 Seed 표면에 결정화가 이루어지도록 설계하였다. 화학 반응으로 인한 pH 변동을 최소화하기 위해 pH auto controller 를 사용하여 pH를 모니터링하고 조절한다.
2.2.1 Lab-scale 회분식 실험방법
회분식 실험은 3.44 L부피의 FBR에 Seed인 0.3∼ 0.7 mm 직경의 silica sand를 50 cm 채운 후 Seed 유동화를 위하여 정량 펌프를 이용하여 1.02 L/min의 유속으로 순환시키면서 진행하였다. 상온 및 대기압 조건에서 실험을 진행하였고, 최적의 불소이온 제거율과 불화칼슘 결정화 효율 조건을 도출하기 위한 실험인자는 HRT (Hydraulic Retention Time), pH, [Ca2+]/[F-](mol/mol) ratio 그리고 Seed height로 선정하고 실험을 진행하였다. 상세한 실험 조건은 Table 2에 나타내었다. 회분식 실험 조건은 pH 3∼9, 약품 주입원은 35% CaCl2 10배 희석하여 저유량 정량펌프를 이용하여 지속적으로 첨가하였다. Seed height에 따른 영향을 관찰하기 위하여 각 20, 30, 40, 50, 70, 100 cm를 채워 넣은 후 Seed height별 유동화를 위해 Upflow velocity 20m/hr에 맞춰 유량을 512, 563, 572, 580, 596, 614 mL/min으로 조절하였다.
불화칼슘 결정 회수를 위해서는 Seed 표면에서의 불화칼슘 결정화를 통해 제거되는 양을 확인하는 것이 필수적이며, 이를 위해 처리수를 대상으로 0.45 μ m GFC filter 이용하여 여과하였고 여과 전⋅후의 제거율 비교를 통하여 결정화 효율을 판단하였다. 본 연구에서 사용한 결정화 효율은 식 (2)와 같이 계산되었다.
여기서, Effluent filtered removal: 결정화와 여과를 통한 F- 제거율
Effluent unfiltered removal: 결정화를 통한 F- 제거율
2.2.2 Lab-scale 연속 실험방법
회분식 실험을 통해 도출된 최적 운전조건을 토대로 실험실 규모의 FBR반응기의 성능 평가를 위해 연속 실험은 장기간 진행되었다. 회분식 실험을 통해 도출된 결과인 HRT 5 hr를 바탕으로 유입유량은 16.5 L/day 주입하고 동일하게 배출하였다. 약품은 35 % CaCl2 10배 희석하여 원수 내 불소 이온 대비 칼슘을 0.29 mL/min으로 지속적으로 주입하였으며 Seed의 유동화 유지를 위하여 Upflow velocity 20 m/hr로 순환하였다. pH는 auto controller로 최적 pH 6에 맞춰 조정하여 진행하였다. 불소제거 효율을 모니터링 하기 위하여 처리수는 하루 1회, 0.45 μ m GFC filter를 이용하여 시료 중 절반을 여과하였으며 이후 여과하지 않은 시료와 여과한 시료의 F- 농도를 측정하여 불소제거율 및 불화 칼슘 결정화 효율을 판단하였다. 또한, 결정 성장을 파악하기 위하여 Seed height 변화율을 일마다 모니터링하였다.
2.3 분석방법
모든 용존성 시료는 0.45μ m GF/C (Whatman, UK) 필터로 여과하여 사용하였다. pH는 pH meter (Model ST300, Ohaus)를 이용하였으며, Calibration curve는 일주일마다 pH 4, 7, 10 기준으로 고정하였다. 불소 및 칼슘을 포함한 이온성 성분의 분석은 Ion chromatograph (IC, Model Ion chromatography-mass spectrometer, Metrohm)로 분석하였고 결정 생성물의 구조 조성 및 결정성은 High-resolution X-ray diffractometer (HR-XRD, Model D8 adcance, Bruker)을 사용하여 측정하였으며, 스캔은 θ= 5°에서 90°까지 수행되었다.
3. 결과 및 고찰
3.1 HRT에 따른 불소제거 및 불화칼슘 결정화 효율 변화 특성
FBR을 활용한 불화칼슘 결정화 공법에서는 Seed 표면에서의 결정화 효율이 처리수의 불소이온 농도 및 불화칼슘 결정 회수에 큰 영향을 미치는 중요한 요소이다. Seed 표면에서의 결정화 효율이 낮을 경우, CaF2 형태의 미세 입자가 처리수에 포함되어 유출될 수 있으며 이로 인해 처리수 내의 불소 이온 농도가 상승하는 문제가 발생된다. 이러한 문제를 해결하기 위해 반응조 내 Seed 표면에서 충분한 결정화를 위한 반응시간을 제공하는 것이 필요하다.
본 연구에서는 다양한 HRT 값에 따른 불소제거 및 결정화 효율을 평가하여 최적의 반응시간을 도출하기 위한 실험을 수행하였다. 실험 범위는 3시간부터 8시간까지 1시간 간격으로 조절되었으며, 각 실험에는 불화칼슘 결정화를 위해 필요한 이론적 필요 칼슘량인 0.5 [Ca2+]/[F-](mol/mol) ratio를 유지하도록 동일한 농도의 CaCl2 약품을 주입하였다.
HRT변화에 따른 실험결과는 Fig. 2와 같다. HRT 값의 증가에 따라 불소 이온과 칼슘 이온의 화학반응 시간이 증가하게 되어 불소제거율이 증가하는 경향을 보였다. 특히 HRT가 5시간 이상부터는 불소제거율이 약 80 % 내외로 더 이상 증가하지 않고 일정한 수준을 유지하는 것으로 관찰되었다. 이러한 현상은 불화칼슘의 물에 대한 용해도 (pK sp=10.4 at 25℃)가 높아서 이론적으로 얻을 수 있는 농도 한계치 이하로 불소를 제거하기 어렵다는 것을 반영한 것이며, Kang 및 Chae의 연구 결과와도 일치한다.[16-18] 또한, 결정화 효율 측면에서는 HRT 5시간 조건에서 98.4 %의 높은 효율이 관찰되었다. 이러한 결과는 CaF2 형태의 미세 입자가 처리수로 유출되지 않고 Seed 표면에서 CaF2 결정 형태로 안정적으로 성장한 것으로 판단된다. 따라서, 실험 결과를 종합하여 각 HRT 값에 따른 불소 제거율과 결정화 효율을 고려하여 최적의 반응시간으로 HRT 5시간을 도출하였다.
3.2 pH에 따른 불소제거 및 불화칼슘 결정화 효율 변화 특성
불소 이온 제거와 불화칼슘 결정화 효율은 일반적으로 pH 변화에 밀접한 관계가 있는데, 이는 불소 이온이 용액으로부터 해리됨에 따라 변화하는 것으로 알려져 있다.[19] 이에 따라 본 연구에서는 pH 변화에 따른 불소 제거율 및 결정화 효율의 영향성을 평가하기 위한 실험을 진행하였다. 실험 범위는 pH 3부터 9까지 조절되었으며, 각 실험에는 불화칼슘 결정화를 위해 필요한 이론적 필요 칼슘량인 0.5 [Ca2+]/[F-](mol/mol) ratio를 유지하도록 동일한 농도의 CaCl2 약품을 주입하였다.
pH 변화에 따른 실험결과는 Fig. 3과 같다. pH 6까지 불소제거율 및 결정화 효율이 pH와 비례하여 상승하는 경향을 보였고, pH 6에서는 불소제거율은 82.3 %, 결정화 효율은 97.3 %로 나타났다. 반면, pH 7 이상부터는 불소제거율 및 결정화 효율이 급격하게 하락하는 경향을 보였다. 이러한 결과는 Fig. 4.a 그래프[20] 에서 보여 주듯이 pH 4 이하의 산성 조건에서 대부분의 불소가 HF 형태로 수소 이온과 결합하여 CaF2 경정 생성률이 낮은 것으로 사료된다. 또한, 불화칼슘의 용해도는 중성 조건보다는 산성 조건에서 높기 때문에, 산성 조건에서는 불소 제거효율이 상대적으로 낮게 나타난 것으로 해석할 수가 있다. 반면, pH 4 이상 pH 6 사이에서는 불소가 이온화되어 F- 이온 형태로 존재하며, 이 이온은 다양한 금속 이온과 결합하여 Fig. 4.b 그래와 같이 쉽게 다양한 염을 형성한다. 이러한 이유로 pH 6 조건에서 높은 CaF2 결정화 효율을 보인 것으로 사료된다. 그러나 Fig. 4. b 그래프와 같이 pH 6 이상의 알칼리 조건에서는 불소 이온과 함께 다양한 착화합물 형태로 결합하여 결정화 효율을 저해할 수 있다는 것을 확인할 수가 있다.[21]
본 실험을 통해 pH값이 Seed 표면의 결정화 효율에 큰 영향을 미치는 주요한 인자임을 확인하였으며, 높은 불소 제거율 및 결정화 효율 측면을 고려하여 최적 pH 값으로 6을 도출하였다.
3.3 Ca2+ 농도에 따른 불소제거 및 불화칼슘 결정화 효율 변화 특성
불화칼슘 결정화를 위해서는 적정 칼슘이온 농도가 요구되며, 화학식을 바탕으로 계산하면 이론적 칼슘 필요량은 0.5임을 확인할 수 있다.
본 연구에서는 Ca2+ 주입량의 변화에 따른 불소제거율과 결정화 효율을 확인하기 위하여 CaCl2약품을 이용하여 실험을 진행하였다. 실험결과는 Fig. 5와 같다. 칼슘의 주입량이 증가할수록 불소와의 반응성 또한 증가하므로 불소제거율이 지속적으로 증가하는 경향이 나타났다. 이는 칼슘의 주입량을 증가시키면 공통이온 효과에 의해 이론적인 불소 농도의 한계치보다 더 낮은 농도를 얻을 수 있기에 이론적인 당량인 0.5 [Ca2+]/[F-](mol/mol) ratio 대비 0.65 [Ca2+]/[F-](mol/mol) ratio 에서의 불소 제거율은 80.5 %에서 83.2 %로 2.7 % 증가한 것을 관찰할 수 있다.[18] 반면, 불소 결정화 효율의 경우 0.55 [Ca2+]/[F-](mol/mol) ratio 조건에서 95.1 %로 최대 효율을 보이고, 그 이상의 범위인 0.60 및 0.65 [Ca2+]/[F-](mol/mol) ratio의 범위에서의 불소 결정화 효율은 89.4 %, 86.4 % 로 급격히 감소하는 것으로 확인되었다. 이러한 결과는 과다한 칼슘 이온으로 인해 불화 칼슘의 결정화 반응이 아닌 다른 화합물의 반응으로 전환되는 결과임을 보여준다.[20] 위 실험 결과와 경제적인 측면을 고려하여, 고순도의 불화 칼슘을 얻기 위한 최적 응집제 주입량은 0.55 [Ca2+]/[F-](mol/mol) ratio 로 결정하였다.
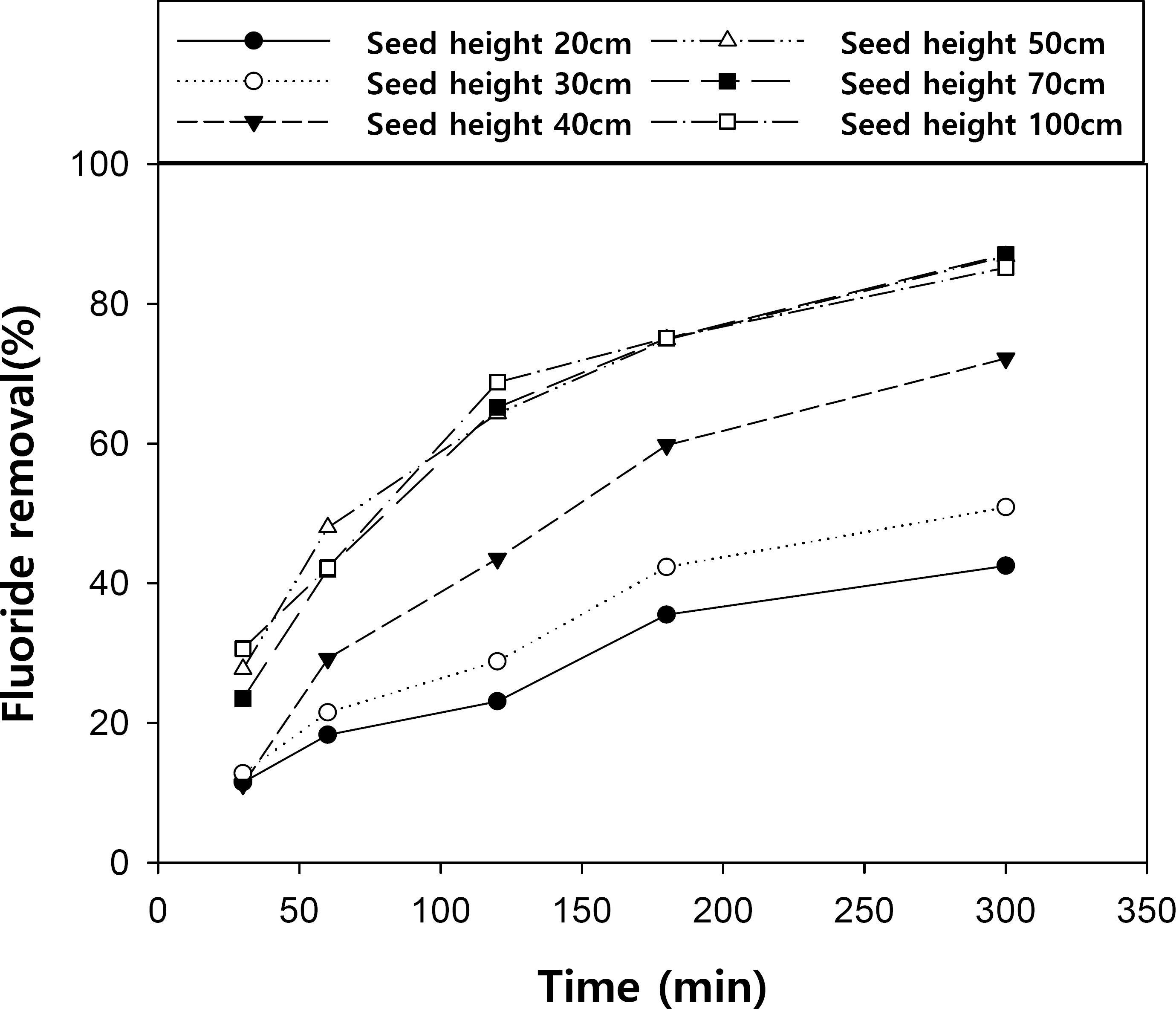
3.4 Seed height에 따른 불소제거 및 불화칼슘 결정화 효율 변화 특성
선행 연구에 의하면 FBR내 Seed 양이 증가할수록 오염물질의 제거효율 증가 및 흡착 유도 기간을 단축시킬 수 있다고 보고되어지고 있다.[22] 따라서 본 연구에서는 Seed 양에 따른 불소제거 효율을 비교해 보고자 FBR 반응기 내 동일한 종류와 직경의 Seed를 초기에 각 20, 30, 40, 50, 70, 100 cm 높이로 채운 후 실험을 진행하였고, 결과는 Fig. 6과 같다. 전체적으로 선행 연구와 마찬가지로, Seed의 양이 증가함에 따라 접촉 가능한 표면적도 증가하게 되어 불소 제거율이 상승하는 경향을 관찰하였다. 이는 불화칼슘 형성 반응에서 속도 제한 단계가 핵생성 단계이기 때문으로 판단되며, 주입된 Seed 양과 처리효율 사이에는 비례 관계가 존재함을 시사하다. 하지만 Seed 높이 50 cm 이후 양이 증가하여도 유사한 제거율을 관찰할 수 있는데 이는 일정량 이상 주입될 경우 반응 촉진 및 흡착이 최대로 이루어져 순환 여부와 상관없이 불소제거 효율이 일정하게 유지되어지고, Seed의 양이 증가할수록 반응기 내 하부압력이 증가하게 됨에 따라 모든 입자들을 유동성 있게 유지할 수 없기 때문으로 사료된다.[23] 따라서, 유속을 제공하는 펌프 전력 및 seed 사용량 등 경제성을 고려하여 최대 효율 결과를 나타내는 50cm의 seed height를 최적으로 결정하였다.
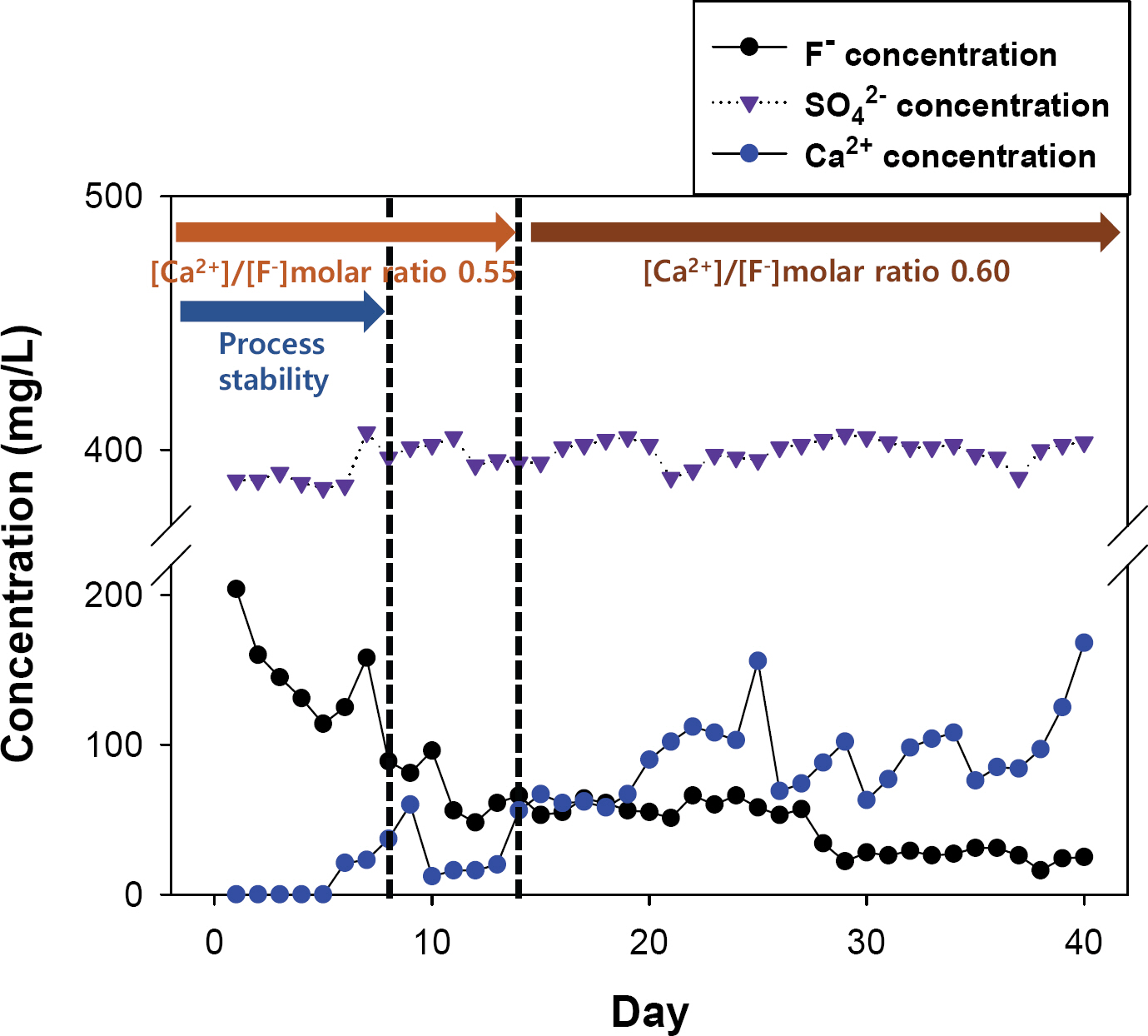
3.5 장기간 연속운전을 통한 불소제거 및 불화칼슘 결정화 효율 평가
Lab-scale 회분식 실험을 통해 도출된 최적운전인자를 토대로 40일간 연속운전을 진행하여 불소제거 효율 및 고순도의 불화칼슘 결정의 생산 가능성을 평가하였다. 실험 결과는 Fig. 7에 나타내었다. 1일부터 8일까지는 FBR 공정의 안정성이 확보되지 않아 불소 제거율 및 결정화 효율이 불안정한 것을 확인할 수 있었다. 또한 칼슘 이온의 농도가 모두 소진되어 추가적으로 불소 이온 제거가 이뤄지지 않아 14일 이후 칼슘 주입을 0.55 [Ca2+]/[F-](mol/mol) ratio에서 0.60 [Ca2+]/[F-] (mol/mol) ratio 로 증가시켰다. 이후 불소 이온 평균 농도는 40∼45 mg/L, 불소 제거율은 평균 86%로 안정됨을 볼 수 있었다. 또한 0.60 [Ca2+]/[F-](mol/mol) ratio 조건에서의 결정화 효율도 평균 95%로 나타났다. 이러한 결과는 제거되는 불소이온은 미세입자 형태의 불화 칼슘의 생성보다 Seed 표면에 직접적으로 흡착하여 CaF2 결정 형태로 생성되는 것으로 판단된다.
Seed 표면에 CaF2 결정의 생성 여부를 판단하기 위해 연속운전 5시간 그리고 40일 후 생성된 결정에 대한 HR-XRD 분석을 진행하였으며, 실험결과는 Fig. 8와 같다. 초기 silica sand는 SiO2의 피크 강도가 가장 높은 것으로 보아 SiO2의 성분이 대부분인 seed로 판단된다. 이후 반응시간이 증가함에 따라 SiO2의 피크 강도는 점차 감소하였으며, 특히 연속 운전 40일 후 seed의 경우 SiO2의 피크 및 기타 불순물의 피크 강도가 감소하며 CaF2의 피크의 형상을 나타내고 있다. 이러한 결과는 선행 불화칼슘 연구에서의 XRD 패턴과도 일치하는 것으로 나타났다.[24,25]
4. 결론
본 연구에서는 고농도의 불소를 함유하는 산업폐수를 처리할 때 효과적으로 불소를 처리하고 또한 유가자원으로 재이용 가능한 형태의 CaF2 결정으로 회수 가능한 FBR 공법 개발을 위한 연구를 수행하였으며 이를 위해 HRT, pH, Ca2+ 주입량, 그리고 Seed 주입량에 따른 영향성을 검토하고, 장기간 연속 운전을 통해 현장 적용 가능성을 평가하였다. 연구 수행결과 다음과 같은 결론을 얻었다.
1) HRT에 따른 영향성 검토 결과 HRT 값의 증가에 따라 불소제거율이 증가하는 경향을 보였으나 5시간 이상부터는 불소제거율이 약 80 % 내외로 더 이상 증가하지 않고 일정한 수준을 유지하였다. 또한 결정화 효율 측면에서 HRT 5 시간에서 98.4 %의 최대효율을 관찰하여 최적 반응시간으로 도출하였다.
2) pH에 따른 영향성 검토 결과 pH 4 이하 산성 조건에서는 HF 결합형태를 띄어 불소제거율 및 결정화 효율이 낮았으며 이후 pH 6까지 불소제거율 및 결정화 효율이 pH와 비례하여 상승하는 경향을 보였으나 pH 7 이상부터는 착화합물과의 결합으로 불소제거율 및 결정화 효율이 급격하게 하락하는 경향을 보였다. 이에 pH 6조건에서 최대 불소제거율은 82.3 %, 결정화 효율은 97.3 %을 관찰하여 최적 pH로 도출하였다.
3) [Ca2+]/[F-](mol/mol) ratio에 따른 영향성 검토 결과 칼슘의 주입량이 증가할수록 불소와의 반응성 또한 증가하므로 불소제거율이 80.5 %에서 83.2 %로 증가하는 경향이 나타났으나 과다한 칼슘 이온으로 인해 불화 칼슘의 결정화 반응이 아닌 다른 화합물의 반응으로 전환되어 결정화 효율은 0.55 [Ca2+]/[F-](mol/mol) ratio 조건에서 95.1%로 최대를 나타낸 후 점차 89.4 %, 86.4 %로 감소하는 것을 관찰하여 고순도의 불화칼슘 회수를 위하여 0.55 [Ca2+]/[F-](mol/mol) ratio을 최적 칼슘 주입량으로 도출하였다.
4) Seed height에 따른 영향성 검토 결과 Seed의 양이 증가함에 따라 접촉 가능한 표면적도 증가하게 되어 불소 제거율이 상승하는 경향을 관찰하였으나 높이 50 cm 이후 일정량 이상 주입될 경우 반응 촉진 및 흡착이 최대로 이루어져 Seed양이 증가하여도 유사한 제거율을 보였다. 이에 경제성을 고려하여 최대 효율 결과를 나타내는 50 cm를 최적 seed height로 도출하였다.
5) 장기간 연속운전 결과 8일까지 공정의 안정성 미확보 및 칼슘이온의 소진으로 인하여 낮은 불소제거율 및 결정화 효율을 관찰하여 이후 0.55 [Ca2+]/[F-] (mol/mol) ratio에서 0.60 [Ca2+]/[F-](mol/mol) ratio 로 증가시킨 결과 불소 제거율은 평균 86 %, 결정화 효율은 평균95.1 %로 유지하였다. 또한 HR-XRD 분석을 통하여 CaF2 생성 여부 판단 결과 반응시간이 증가할수록 SiO2의 피크 강도가 감소하며 CaF2의 피크 형상을 나타낸 것을 관찰하였다.
후속 연구는 본 연구에서 얻은 실험 결과를 기반으로 실제 산업 현장에 적용될 수 있는 불화칼슘 결정화 공법을 개발하기 위해 연속반응조 설계 및 최적화, 공정 경제성 분석 등의 연구가 진행될 예정이다.
사사
본 연구는 2022년도 중소벤처기업부의 기술개발사업 지원에 의한 연구임 S3276954
References
Biography

◉◉ 이가영
◉ 2022.01∼ 현재 전주대학교 석사과정

◉◉ 정종민
◉ 2021.03∼ 현재 전주대학교 조교수
◉ 2013.04∼2021.02 삼성전자 반도체 사업부 연구원
◉ 2009.08∼2013.03 동경대학교 환경공학 박사
◉ 2008.04∼2009.08 한국과학기술연구원 연구원