나트륨 이차전지용 양극재의 최근 발전동향
Recent Advances in Cathode Materials for Na-Ion Batteries
Article information
Trans Abstract
In the quest for sustainable and cost-effective energy storage solutions, sodium-ion batteries (SIBs) have emerged as a promising alternative to lithium-ion batteries, owing to their similar chemical compositions, mechanisms, and compatibility with existing battery technologies. Despite their potential, SIBs face challenges such as lower capacity and structural instability, which hinder their widespread adoption. This paper provides a comprehensive overview of cathode materials used in SIBs, focusing on their electrochemical properties, limitations, and the ongoing research aimed at overcoming these challenges. We delve into the current state of SIB technology, highlighting the critical role of cathode materials in enhancing the performance, durability, and cost-effectiveness of SIBs. Furthermore, we explore future directions for research and development, including novel materials and innovative approaches to improve the capacity and structural stability of SIBs. By addressing these key issues, this paper aims to contribute to the advancement of SIB technology and its application in next-generation energy storage systems.
1. 서론
1991년 Sony가 최초로 리튬이온 배터리를 상용화한 이후, 최근 리튬이온 배터리는 높은 에너지 밀도와 긴 사이클 수명 등의 우수한 전기화학적 성능을 기반으로 휴대용 전자기기, 핸드폰, 전기 자동차용 배터리 등으로 상용화되며 에너지 저장 기술 분야에서 유례없는 호황을 누리고 있다. 특히, 전기 자동차와 하이브리드 전기 자동차 시장의 성장으로 인해 리튬이온 배터리의 수요가 급격히 증가했지만, 지각 내 리튬 원자재의 분포가 고르지 못하고 한정적인 매장량으로 인한 비용증가와 공급부족에 대한 우려가 증대되고 있다.[1] 이러한 문제점들을 극복하기 위해 자원이 풍부하고 리튬 원자재보다 가격이 저렴하며 리튬이온 배터리와 유사한 전기화학적 성능을 낼 수 있는 차세대 이차전지 재료 개발을 추진 중이다.
최근 논의되는 모든 차세대 이차전지 재료 중 소듐이온 배터리에 대한 연구개발이 활발하게 진행되고 있다. 소듐은 리튬보다 자원 매장량이 월등히 풍부하며, 리튬이온 배터리용 양극재 합성에 사용되는 원자재인 탄산리튬은 톤당 약 2400만원인 반면, 소듐이온 배터리용 원자재인 탄산소듐은 탄산리튬 가격의 76분의 1 수준인 톤당 약 31만원에 불과하다.[2] 또한, 소듐이온 배터리는 리튬이온 배터리와 유사한 구조 및 구성요소, 반응 메커니즘, 그리고 셀 제조 공정을 공유하기 때문에 리튬이온 배터리의 인프라를 그대로 가져올 수 있다는 장점을 가지고 있다.[3-5]
소듐이온 배터리가 상용화되기 위해서는 리튬이온 배터리와 동등한 에너지밀도, 전류밀도와 수명 특성을 가져야 하지만, 소듐이온의 이온반경(1.02 Å)이 리튬이온의 이온반경(0.76 Å)보다 크기가 커서 충/방전 과정에서 소듐이온의 삽입(sodiation)과 탈리(desodiation)가 일어나는 동안 생기는 구조 변화에 의한 문제점 등으로 인해 현재 소듐이온 배터리의 개발에 많은 노력이 기울여지고 있다. 특히, 소듐이온 배터리용 양극재는 배터리의 용량, 에너지밀도, 수명 특성 등을 결정하는 중요한 역할을 하기 때문에 소듐이온 배터리에 적합한 양극재의 설계 및 개발의 중요성이 대두되고 있다.[4]
소듐이온 배터리용 양극재로는 층상구조 전이 금속 산화물(layered transition metal oxides), 다중음이온 화합물(polyanionic compounds), 프러시안 블루(Prussian blue) 유사체 등의 물질들이 주로 보고되고 있다. 지금까지 보고된 여러 양극 활물질 중 층상구조 전이 금속 산화물은 적절한 작동 전압 범위와 높은 비용량을 가지며 손쉬운 합성법으로 인해 상업적 응용에 가장 유망한 양극 재료 중 하나로 평가받고 있다.[5] 층상구조 전이 금속 산화물의 합성 방법 중 공침법을 통해 전구체를 형성하고 하소를 통해 양극재를 합성하는 방식은 전구체 수준에서 입자 형태의 균일성과 제어가 가능하며 이를 통해 에너지밀도가 향상과 표면 반응성을 감소시킬 수 있어 공기 노출 시에도 양극재의 안전성을 확보할 수 있다.[6] 또한 산업적인 관점에서, 공침법을 이용하여 소듐 층상계 산화물 양극재를 합성하게 되면 기존의 리튬 층상 산화물 양극재를 제조하는 프로토콜을 공유할 수 있다는 장점이 있다. 본 논문에서는 소듐이온 배터리용 양극재의 최근 연구 트렌드를 소개하고, 층상구조를 갖는 전이금속 산화물의 구조적 특징과 한계점, 그리고 서로 다른 전이 금속이 포함되었을 때 전이금속 산화물의 전기화학적 특성 변화 등을 다루고자 한다.
2. 소듐이온 배터리의 작동원리와 구성요소
소듐이온 배터리는 리튬이온 배터리와 유사한 전지 제조공정과 반응 메커니즘을 가지며, 상용 리튬이온 배터리와 마찬가지로 양극, 음극, 분리막, 전해질의 4가지 구성요소로 이루어져 있다.[7] 작동 메커니즘 또한 리튬이온 배터리와 거의 유사하다. 소듐이온 배터리의 충전 과정은 전지에 전압을 가하여 외부 도선을 통해 전자를 양극에서 음극으로 이동시킬 때, 전하중성을 맞추기 위해 소듐이온 또한 양극에서 전해질을 통해 음극으로 이동하는 비자발적인 과정을 거친다. 반대로 방전 시에는 음극에서의 소듐이온의 화학포텐셜이 양극에서의 화학포텐셜보다 높으므로, 소듐이온은 음극에서 양극으로 자발적으로 이동하고, 전자도 외부 도선을 따라 음극에서 다시 양극으로 이동하며 방전 과정이 일어나게 된다. 소듐이온 배터리는 이러한 충전과 방전 과정을 거치며 지속적으로 사용이 가능한 전지이며, 화학 에너지를 전기 에너지로 변환시켜주는 장치에 해당한다.
소듐이온 배터리의 양극재는 배터리의 총 용량을 결정하는 핵심 요소로, 소듐을 포함하는 화합물을 기반으로 한다. 양극재에 저장될 수 있는 소듐이온의 양이 많을수록 배터리의 용량은 증가하게 되며, 양극재의 구조적 및 열적 안정성은 배터리의 안전성에 직접적인 영향을 미친다. 현재까지 소듐이온 배터리의 양극재는 리튬이온 배터리의 양극재에 비해 상대적으로 낮은 성능을 보이고 있으며, 이의 성능 개선을 위한 연구가 활발히 진행되고 있다.[8] 반면, 음극재로는 소듐이온의 큰 이온 반경을 수용할 수 있는 하드 카본이 주로 사용된다.[9] 리튬이온 배터리에서 널리 사용되는 흑연(graphite)은 소듐이온 배터리에서의 음극재로 적합하지 않다는 것이 밝혀졌다.
전해질은 소듐이온의 이동을 촉진하며 전기적 절연성 및 높은 이온 전도성을 가져야 한다. 일반적인 소듐이온 배터리에서는 NaFP6나 NaClO4와 같은 소듐염(Na salt)을 포함하는 액체 전해질이 사용되며, 이는 넓은 작동전압 및 온도 범위에서의 우수한 안정성을 제공한다.[8,10,11] 분리막은 양극과 음극 사이의 물리적 접촉을 차단하는 동시에 소듐이온의 통과를 가능하게 하는 다공성 구조로 이루어져 있다. 분리막으로 사용되는 재료는 기계적 강도, 화학적 안정성 및 내열성이 뛰어난 고분자 필름이 주로 사용된다.[12]
3. 층상 구조 전이금속 산화물
최근 소듐이온 배터리 분야에서는 층상 구조를 지닌 전이금속 산화물 양극재에 대한 연구가 활발히 진행되고 있다. 이러한 층상 구조 전이금속 산화물은 다른 양극재 대비 높은 이론적 용량, 적절한 작동 전압, 그리고 간단한 합성 방법 등의 장점을 바탕으로 소듐이온 배터리용 양극재로서 큰 가능성을 보여주고 있다.[13] 특히, 이러한 층상 구조는 소듐이온이 2차원적으로 확산될 수 있는 경로를 제공하여 충전 및 방전 과정에서의 이온 확산 속도를 가속화하여 우수한 율속 특성을 나타낸다는 점에서 주목받고 있다.
층상구조 전이금속 산화물의 화학식은 일반적으로 Na x(TM)O2 (transition metal, TM)로 표현된다. 이들의 구조적 특징은 전이금속 산화물(TMO) 층이 팔면체로 연결되어 구성되고, 이 TMO 층 사이에 알칼리 금속 이온이 위치하는 것이다. 이러한 구조적 배열은 소듐이온의 점유 위치와 함량에 따라 O3형과 P2형으로 구분되며, 이는 각각 소듐이온이 팔면체와 사방정 위치에 점유함을 나타낸다. O3형은 Na x(TM)O2 (0.7 ≤ × ≤ 1)로, P2형은 Na x(TM)O2 (x ≤ 0.7)로 정의되며, 이들은 산소적층 패턴인 “ AB CA BC”와 “ AB BA”에 따라 구분된다.[14] 특히, 결정격자 안에서 면 내 왜곡이 존재할 경우, O3형과 P2형의 명칭에는 소수 기호(’)가 추가되어 이를 표현한다. O3형과 P2형 층상 구조는 각각 고유의 장단점을 가지며, 최근 연구는 이들의 단점을 상호 보완할 수 있는 혼합형인 OP2형에 대한 탐구로 확장되고 있다.[15] 이러한 층상구조 전이금속 산화물 양극재의 발전은 소듐이온 배터리의 성능 향상과 상용화를 위한 중요한 연구 분야로 자리매김하고 있다.
3.1 O3형 층상구조 전이금속 산화물
최근의 연구에서 O3형 층상구조 양극재는 P2형에 비해 소듐이온을 다량 함유할 수 있으므로 높은 초기용량, 에너지 밀도 및 우수한 사이클 특성을 제공한다고 알려져 있다.[17] 그러나 소듐이온의 큰 원자 반경으로 인해 충전 및 방전 과정에서 소듐이온의 삽입 및 추출 시 다양한 구조로의 상전이를 일으키며, 이로 인해 에너지 효율이 감소하는 문제가 발생한다.[18] 특히, 소듐이온의 확산 경로가 팔면체에서 사면체를 경유하여 다시 팔면체로 확산되는 과정은 소듐이온의 확산 속도를 늦추고, 결국 충전 및 방전 속도와 구조적 가역성을 저하시킨다(Fig. 1). NaNi1/3 Fe1/3 Mn1/3 O2, NaNi0.5 Mn0.5 O2 등의 대표적인 O3형 층상구조 양극재는 이러한 특성을 지니고 있다. T. Song 그룹(T. Song et al., 2023)은 NFM 전구체를 공침법을 통해 합성하여 이를 최종 양극재까지 발전시켜 전기화학적 성능을 평가한 연구를 수행하였다.[19] 특히, pH 조건과 전이금속 대비 NH4 OH의 몰비 조절을 통해 최적의 전구체 특성을 도출하였으며, pH 10에서 11로 증가하고 NH4 OH의 몰 농도가 전이금속 대비 1.2배일 때, 초기 용량이 0.1 C 에서 157 mAh/g의 용량을 보임을 확인하였다.
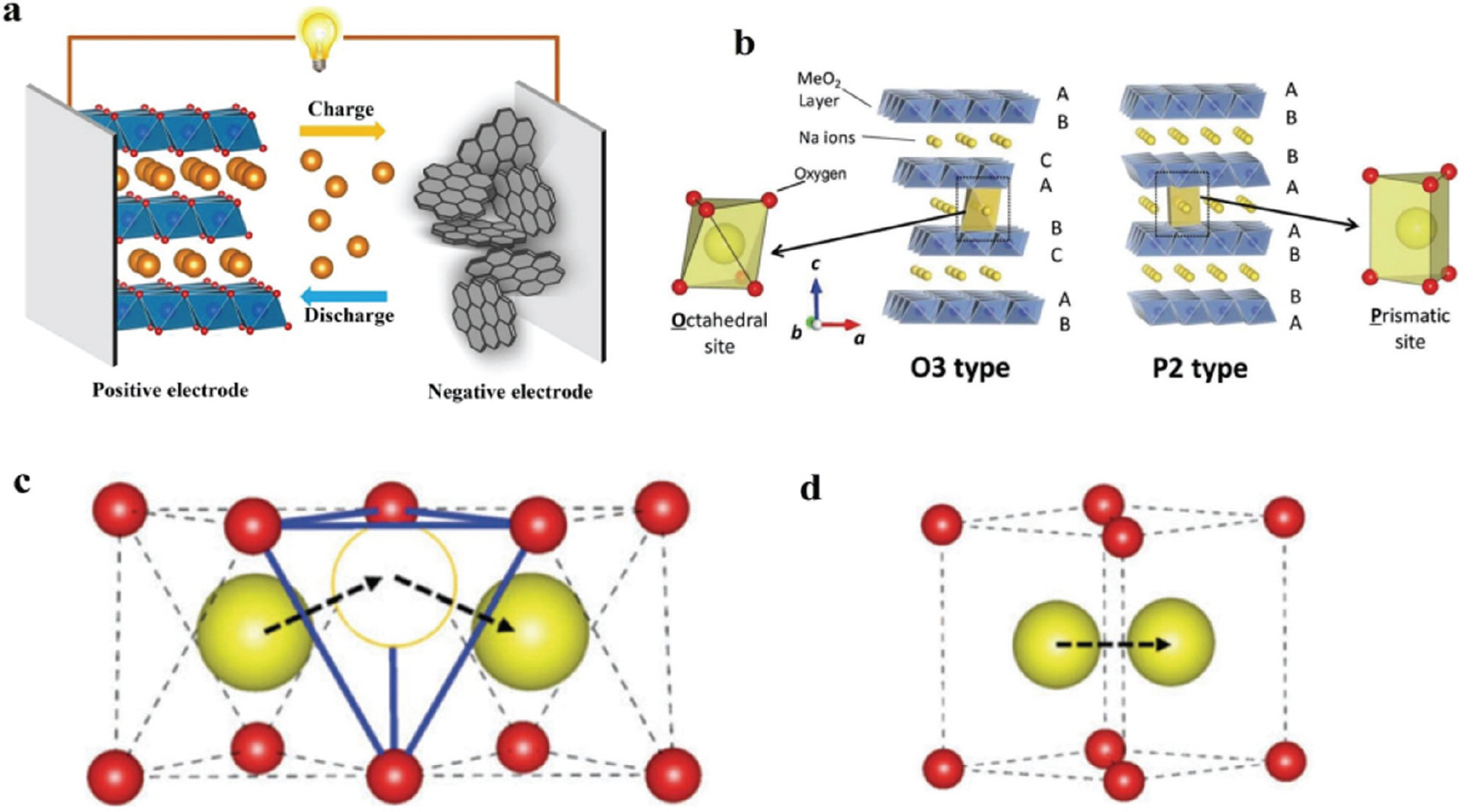
a. Working principles diagram of sodium ion batteries. b. Schematic illustrations of crystal structures of O3 and P2 type Na x TMO2. c. The indirect Na-ion diffusion path with the intermediate tetrahedron site in O-type frameworks. d. The direct Na-ion diffusion path without the intermediate site in P-type frameworks. The red and yellow balls represent oxygen ions and sodium ions[16]
S. Komaba 연구팀(S. Komaba et al., 2012)은 전압 범위에 따른 NaNi0.5 Mn0.5 O2 양극재의 성능을 평가하여, 2.2-3.8 V 범위에서 125 mAh/g, 2.2-4.5 V 범위에서 185m Ah/g의 초기용량을 나타냄을 보고하였다.[20] S. Xu 연구팀(S. Xu et al., 2022)은 Na2/3 Ni1/3 Ti2/3 O2 층상구조 양극재를 합성하여 0.1 C에서 175 mAh/g의 초기용량과 300 사이클 후에도 112 mAh/g 정도의 용량이 유지됨을 확인하였다.[21] L. Wan 연구팀(L. Wan et al., 2017)은 NaNi0.5 Mn0.5 O2 양극재에 Cu와 Ti를 도핑하여 NaNi0.45 Cu0.05 Mn0.4 Ti0.1 O2를 합성하고, 이를 통해 2-4 V 전압 범위에서 124 mAh/g 비용량과 1 C 조건에서 500 사이클 후에도 약 70%의 용량 유지율을 달성하였다는 연구 결과를 발표하였다.[22]
Q. Li 연구팀(Q. Li et al., 2021)의 최근 연구에서는 Mn 기반 층상구조 산화물 양극재의 주요 단점 중 하나인 Mn3+ 의 얀-텔러 왜곡이 사이클 성능 및 속도 성능 저하를 초래한다는 문제점을 지적하였다.[23] 이러한 문제를 극복하기 위해, 연구팀은 Al 도핑 방법을 적용하여 NaMn0.5 Al0.4 O2 양극재를 개발하였다. 해당 연구에서 합성된 양극재는 층상구조의 안정성을 향상시키고, 얀-텔러 효과의 영향을 감소시키며, 전이금속 이온의 이동을 효과적으로 억제할 수 있음을 보여주었다. 이로 인해, 1-4 V의 전압 범위에서 160 mAh/g의 높은 초기용량을 달성하였으며, 100 사이클 후에도 81%의 용량 유지율을 유지함으로써 장기간 사용에도 뛰어난 성능을 보유할 수 있음을 입증하였다(Fig. 2). 이러한 연구 결과는 소듐이온 배터리 양극재의 상당한 성능 개선 가능성 및 향후 기술 발전에 기여할 수 있는 유망한 방안을 제시하고 있다.

The electrochemical performance of Na/NMA and Na/NMO half-cells. a. Charge– discharge curves of NMA cathode at 20 mA g−1. b. dQ/dV versus voltage of NMA and NMO cathodes at 20 mA g−1 (inset, intensity ratios for redox peaks of NMA and NMO at 3.60, 2.62, and 2.45 V). c. Rate performance of NMA and NMO at different current densities (inset, the normalized rate performance vs cycle numbers curves). d. Cycling performance and Columbic efficiency of NMA and NMO cathodes at 500 mA g−1. e. EIS curves of Na/NMA and Na/NMO half-cells, (inset, Z′ vs ω−1/2 curves and equivalent circuit diagram). f. Na+ diffusivity calculated by EIS at different voltage of NMA and NMO[23]
3.2 P2형 층상구조 전이금속 산화물
최근 연구에 따르면 O3형 층상구조 양극재는 P2형보다 더 많은 소듐이온을 함유할 수 있어 높은 초기 용량, 에너지 밀도 및 우수한 사이클 성능을 제공한다고 알려진다. 그러나 소듐이온의 큰 원자 반경 때문에 충전과 방전 과정에서 소듐이온의 삽입과 추출이 다양한 구조 변화를 일으키며 이로 인해 에너지 효율이 감소하는 문제가 발생하게 된다. 특히, 소듐이온이 팔면체 중심자리에서 사면체를 거쳐 다시 팔면체 중심으로 확산되는 과정은 소듐이온의 확산 속도를 늦추고, 결국 충전 및 방전 속도와 구조적 가역성을 저하시킨다.
P2형 층상구조 양극재는 O3형 층상구조 양극재에 비해 이온 전도도가 높고, 우수한 전력 성능을 보이며, 소듐이온의 삽입 및 추출 과정 동안 유연한 구조적 변화를 보여준다. 이 경우, 소듐이온 확산 시 사면체에서 바로 사면체로 확산되기 때문에 확산 장벽이 낮다고 볼 수 있다. O3형 층상구조 양극재에 비해 P2형은 격자 내 prismatic 위치에 소듐이온이 존재하기 때문에 소듐의 함량자체가 적어 추가적인 첨가제를 통해 소듐 함량을 높여 용량을 높이는 연구도 진행되고 있다.[24] 이러한 노력의 일환으로 T. Hyeon 연구팀(T. Hyeon et al., 2019)은 P2형 NMO 양극재의 낮은 속도 성능 및 사이클 유지 문제를 해결하기 위해 나노 구조 물질을 이용했다.[25] 연구팀은 길이가 8 nm이고 두께가 1 nm 미만인 초박막 산화망간 나노판을 합성하고, 이를 테트라히드로퓨란(tetrahydrofuran, THF)에 분산시킨 후 1 M 의 NaOH 에 에틸렌글리콜(ethylene glycol) 용액과 혼합했다. 해당 용액을 65℃에서 48시간 동안 교반하여 소듐이온이 흡착된 망간 산화물 나노판을 생성한 뒤, 나노판을 대기 중에서 500℃에서 열처리하여 나노판이 층상 구조를 갖는 소듐 망간 산화물 나노입자로의 상전이를 통해 최종 양극재인 Na2/3 MnO2을 합성했다. 합성된 Na2/3 MnO2는 2.0 - 3.8 V 의 전압 범위에서 170 mAh/g 의 초기 용량을 보였고, 10 C 의 높은 율속에서도 135m Ah/g 의 용량을 발현했다.
Y. Cao 연구팀(Y. Cao et al., 2020)은 P2형의 격자 변형과 상 전이로 인한 성능 저하를 막기 위해 Na x MnO2 양극재에 Zn 를 도핑한 Na2/3 Zn1/4 Mn3/4 O2를 합성하였다.[26] 합성된 양극재는 Zn 도핑으로 인해 충전과 방전 과정에서 1% 정도의 낮은 부피 변화를 보였고, 이러한 구조적 안정성을 바탕으로 1.5 - 4.5 V의 전압 범위에서 202 mAh/g 의 인상적인 방전용량을 나타내었다. S. Myung 연구팀(S. Myung et al., 2020)은 Na2/3 Mn0.8 Co0.2 O2 양극재를 합성하였다.[27] P2형의 Na2/3 MnO2 화합물은 초기 용량이 높아 매력적인 양극재 후보 중 하나이지만 Mn3+ 이온의 존재는 전극의 장기적 성능을 저하하기 때문에 Mn3+를 Co3+로 대체하여 Mn3+로 인해 발생하는 얀-텔러 왜곡 효과를 최소화하였다. 합성된 양극재는 1.5 - 4.6 V 의 전압 범위에서 175 mAh/g 의 방전용량을 나타내었다. 또한 300사이클 이후에도 90%의 우수한 용량 유지율을 보였다(Fig. 3).
3.3 OP2형 층상구조 전이금속 산화물
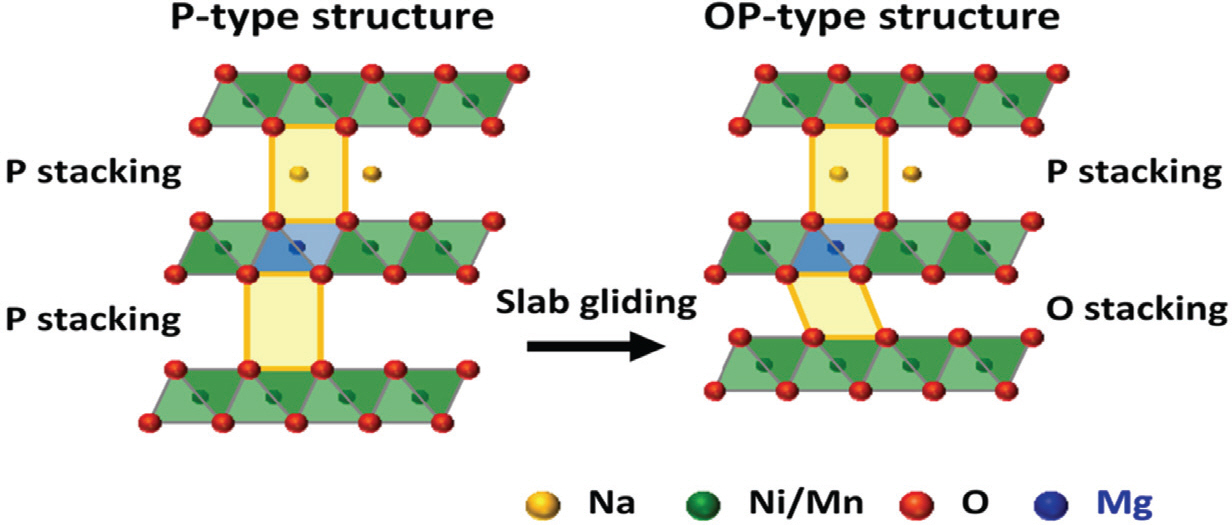
다양한 O3형 층상구조 양극재 중에서 코발트가 없는 NaNi0.5 Mn0.5 O2는 다른 층상구조 전이금속 산화물들에 비해 상대적으로 높은 용량(∼200 mAh/g)을 보이며, 낮은 제조비용으로 인해 매력적이고 유망한 양극 재료로 평가받고 있다.[20] 하지만, 소듐이온의 삽입과 탈리 과정에서 복잡한 상전이를 일으키며 cycle 안정성이 낮아지는 문제가 발생한다. 특히, 소듐의 조성이 0에 가까울 때 나타나는 O3’’으로의 상전이는 slab 간 간격의 심각한 수축을 초래하여 구조적 붕괴를 일으키게 되고, 이는 결국 배터리의 용량저하, 수명 특성 저하 등의 문제로 이어지게 된다.[20] 이에 대한 해결책으로 Y. Sun 연구팀(Y. Sun et al., 2023)은 고전압에서 작동 시 OP2 상으로 상전이가 일어나는 NaNi0.4 Mg0.1 Mn0.5 O2를 합성하였다.[15] 마그네슘은 지각 내 매장량이 풍부하고 독성이 낮은 알칼리 토금속이기 때문에 환경 친화적인 금속으로 평가받는다. 또한 Mg(OH)2의 용해도곱 상수(K sp)는 Ni(OH)2와 Mn(OH)2의 용해도곱 상수 값과 유사한데, 이는 이들 화합물이 공침 과정에서 쉽게 반응할 수 있음을 의미하며, 공침법을 통해 구형의 형태를 갖는 O3형 NaNi0.4 Mg0.1 Mn0.5 양극재를 합성하는데 성공하였다(Fig. 4). 전기화학적 활성이 없는 Mg 으로 Ni 을 10 mol. % 이상 대체하게 되면 소듐의 점유 위치를 P 형 적층 구조로 조절하여 고전압에서의 작동 시 OP2 상이 발생하게 되는데(Fig. 5), 이는 구조적 붕괴를 일으키는 O3’에서 O3’’으로의 상전이를 완화하게 되고 결국 배터리의 수명 및 속도 성능이 증가하게 된다.[29] 본 연구의 결과로서 해당 양극재는2 – 4V 의 전압 범위, 1 C 에서 177 mAh/g 의 초기용량과100 사이클 이후 85.5% 해당하는 용량 유지율을 보였다.
4. 다중음이온 양극재
다중음이온 화합물 또한 소듐이온 배터리용 양극재로써 유망한 물질로 평가받고 있다.[30] 층상구조 산화물 양극재가 단일 O2- 음이온으로 이루어진 것에 비해 다중음이온 양극재는 XO4n- (X=C, S, P, Si, Ti 등)로 이루어져 있다.[31] 층상구조 양극재에 비해 X-O 의 강한 공유결합으로 인해 산소와 전이금속의 결합이 상대적으로 약해진다. 결국 전이금속의 산화환원 준위가 증가하여 높은 작동 전압을 가지는데, 이러한 현상을 유도 현상이라 한다. 이러한 특징을 바탕으로 구조적 안정성이 뛰어나 수 사이클 후에도 용량 유지율이 우수하며 구조적 다양성도 풍부하고, 이온 전도성도 높아 소듐이온 배터리용 전극 재료 후보로 평가받고 있다. 현재 다중음이온 양극재로서 Olivine, NASICON(Natrium super ion conductor), Pyrophosphate, Fluorophosphate, Sulfate, Silicate 등이 있다.
4.1 Olivine 양극재
Olivine NaFePO4는 사방정계 구조에서 공간군 Pnma 로 결정화된다. 여기서 Na 와 Fe 원자는 팔면체 위치의 절반을 점유하고 P 원자는 사면체 위치의 1/8을 점유한다. Na 와 Fe 의 이온 반경의 크기가 다르고 이온 사이의 전하로 인해 FeO6 팔면체와 NaO6 팔면체로 각각 구별되며 이 두 개의 팔면체가 Olivine NaFePO4 상에 존재한다. PO4 사면체는 FeO6 팔면체와 모서리를 공유하여 Olivine NaFePO4의 구조를 형성한다. 하지만 480° C 이상에서 열역학적으로 안정한 Maricite NaFePO4로의 비가역적인 상전이가 일어난다. 이 Maricite NaFePO4는 소듐이온의 확산 경로를 차단하기 때문에 소듐이온 배터리용 양극재로써 적절하지 않다고 여겨진다.[32] 이러한 문제를 개선하기 위해 전기화학적 Li-Na 이온 교환을 통한 NaFePO4의 전기화학적 특성향상 방안들이 제안되기도 한다.
4.2 NASICON 양극재
NASICON 양극재의 가장 대표적인 화학식은 Na3 V2(PO4)3이다. Na3 V2(PO4)3 구조에서 VO6 팔면체는 세 개의 PO4 사면체와 모서리를 공유하여 “랜턴” 구조로 이루어져 있다. Na3 V2(PO4)3 구조에서 소듐이온이 6b 와 18e 공간을 점유하고 있는데, 6b 공간의 소듐이온은 6중 산소 배위를 가지며 c 축 방향으로 두 개의 인접한 V2(PO4)3 사이에 위치한다. 반면에 18e 공간의 소듐이온은 8중 배위를 가지며 두 개의 PO4 사면체 사이에 위치한다. J. Chen 연구팀(J. Chen et al., 2020)은 새로운 NASICON 형 Na4 MnCr(PO4)3을 합성하였다.[33] 해당 연구에서 탄소 매트릭스에 균질하게 내장된 Na4 MnCr(PO4)3 나노 입자는 인해 약 160.5mAh/g 의 가역 용량을 보였다.
4.3 Pyrophosphate 및 Fluorophosphate 양극재
현재까지 가장 많이 연구된 Pyrophosphate 는 single-sodium metal pyrophosphate 인 NaMP2 O7 (M=Fe, V, Ti), two-sodium metal pyrophosphate 인 Na2 MP2 O7(M=Fe, Co, Mn), 그리고 mixed pyrophosphate 인 Na4M3(PO4)2P2O7이 있다.[31] pyrophosphate 는 산소 발생에 따른 phosphate 의 열분해로부터 얻을 수 있는데, 층상구조 양극재의 열역학적 안정성을 능가하고 다른 다중음이온 화합물과 비슷한 열역학적 안정성을 나타낸다. Z. Shen 연구팀(Z. Shen et al., 2016)은 탄소가 코팅된 Na3(VO)2(PO4)2 F 를 합성하였다.[34] F- 의 함유량이 적을수록 전기 음성도가 낮아져 더 낮은 전기화학적 분극, 빠른 Na+ 이온의 확산을 가능하게 해 더 나은 전기화학적 성능을 발휘한다고 보고하였다. 해당 연구에서는 0.2 C 에서 127 mAh/g 의 방전 용량을 나타내었고 2000사이클 이후 81%에 해당하는 높은 용량 유지율을 보였다. 소듐 기반 phosphate 에 전기음성도가 큰 F-을 첨가하면 Fluorophosphate 가 생성된다. 결합 공유성이 강한 음이온 부격자 구조에 높은 이온성 F-가 존재하면 강한 유도 효과를 통해 M n+1/M n+ 상태가 안정화되어 산화/환원이 일어나는 전압이 올라간다. 이러한 관점에서 Na2 MPO4 F(M=V, Fe, Mn, Ni)의 조성을 갖는 fluorophosphate 들도 널리 연구되고 있다.
5. 프러시안 블루 양극재
프러시안 블루 양극재의 일반적인 화학식은 Na x M y[M’(CN)6] z⋅ H2 O 이다. M 은 전이금속이고, M 및 M’ 은 모두 전기화학적으로 산화/환원에 대한 활성을 지닌다.[35] 프러시안 블루 양극재의 면심 입방 구조는 팔면체 hexacyanometallate 복합체가 전이 금속에 결합되어 있는 개방형 구조를 가진다. 이러한 큰 공극이 있는 개방형 구조는 변형률이 0%에 가까워 소듐이온의 빠른 삽입과 탈리를 가능하게 하여 충전 및 방전 동안 부피 팽창이 거의 일어나지 않고[36] 용량 유지율이 좋으며 저렴한 비용과 높은 율속 특성 등의 장점을 가진다. 합성 방법 또한 산업적으로 저렴한 공침법을 통해 간단하게 합성이 가능하고, 무독성인 풍부한 원소로부터 제작이 가능하기 때문에 산업적으로 쉽게 접근이 가능하다. H. Woo 연구팀(H. Woo et al., 2022)은 재가열 공정과 산 에칭을 통해 간단한 단일 침전법으로 다공성 프러시안 블루 양극재를 합성하였다.[37] 합성된 프러시안 블루 양극재는 0.2 C 에서 112 mAh/g 의 비용량을 나타내었고 10 C 에서97 mAh/g 의 비용량을 보였음을 보고했다. 또한 1000번의 사이클 이후에도 85%의 높은 용량 유지율을 보고하였다.
6. 소듐이온 배터리 양극재의 한계점 및 문제점
6.1 공기 및 수분에 대한 안정성
소듐이온 배터리의 상용화 과정에서 전극 재료의 공기 중 안정성은 중대한 요소로 꼽힌다. 전극 재료는 합성과 셀 조립 과정 동안 불가피하게 대기에 노출되며, 이때 구조, 화학 조성 및 전기화학적 특성을 유지해야 한다는 점이 강조된다.[38] 리튬 대비 낮은 전하 밀도와 산화 환원 전위를 가진 소듐으로 인해, NaTMO2 재료는 리튬이온 배터리용 전극 재료보다 공기 중 안정성이 떨어지는 경향이 있다. 특히, NaTMO2 양극재는 흡습성이 높아 습한 대기에 노출될 경우, H2 O가 입자 표면에 흡착되거나 공기 중의 CO2와 반응하여 H2 CO3를 형성하는 경향이 있다.[38] 이 과정에서 H2 O와 H2 CO3는 해리되어 H+, OH-, HCO3-, (CO3)2-로 분해되며, 이들은 양극재 내 소듐이온과 반응하여 NaOH와 NaHCO3 등을 형성한다(Fig. 6.b). 이러한 화학 반응은 양극재 내부의 소듐이온 추출을 가속화하고, 남아있는 소듐이온이 충분하지 않게 되어 전기화학적 성능의 감소로 이어진다. 더욱이, 소듐이온이 추출된 후 해당 층에 물 분자가 삽입되어 수화 상태를 형성하고, 이 과정이 반복될 경우 양극재 내부에 심각한 수화 작용이 일어나 부세라이트 상을 형성할 가능성도 있다.
이 외에도, NaTMO2 물질의 표면층이 수분과 반응하여 전이금속 산화물과 수산화물을 형성할 수 있다는 점도 문제로 지적된다(Fig. 6). W. Zuo 연구팀(W Zuo et al., 2023)에 따르면, NaTMO2 양극재의 공기 중 안정성은 화학적 조성, 재료의 구조, 온도 및 대기 환경에 의해 결정되며, 이는 양극재가 수분 및 공기에 노출되었을 때 내부의 소듐 손실 가능성을 좌우한다.[41] 특히, 첫 번째 충전 과정에서 낮은 작동 전압을 가지는 NaTMO2 재료는 소듐 손실이 더 쉽게 발생하고 수화되기 쉽다.[42] 예를 들어, 코발트와 망간이 풍부한 NaTMO2 재료는 초기 충전 과정에서 쉽게 소듐 손실과 수화가 일어나 용량 감소, 용량 유지율 저하 및 율속 특성 감소 등 전기화학적 성능의 저하를 보인다.
6.2 구조적 변형
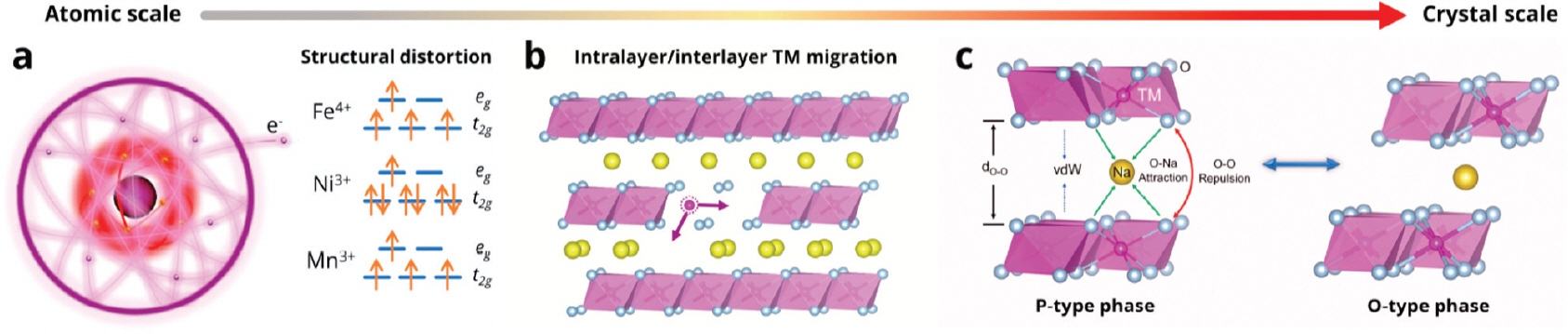
NaTMO2의 전기화학적 성능은 재료의 구조적 안정성과 전극과 전해질 간 계면에 의해 크게 영향을 받는다. 특히, 양극 재료의 구조적 안정성은 2차 전지 내에서 발생할 수 있는 전해질 고갈 문제보다도 중요하게 여겨진다. 양극재의 구조가 변형되거나 왜곡될 경우, 소듐이온의 확산 경로가 좁혀져 방해를 받게 되고, 이는 확산 속도의 감소, 소듐이온을 수용할 수 있는 공간 부족으로 인한 충전/방전 속도 및 용량, 그리고 율속 특성의 저하로 이어진다. 따라서, 양극재의 구조 변형은 전기화학적 성능 감소로 직결되는 중요한 문제로 다루어져야 한다. [43] 양극재는 주로 세 가지 주요 요인에 의해 구조 변형을 겪는다.
첫 번째 요인은 양이온과 산소가 이루고 있는 전자적 구조의 변화로 인한 이방성 구조 변화 혹은 구조의 왜곡이다. 양이온의 층간 이동이 구조적 변형을 유발하는 요인 중 하나인데, 충전과 방전의 과정을 거치며 양이온이 층간으로 이동하게 되면 NaxCrO2, Na x FeO2 같은 층상 구조의 양극재가(0.5 ≤ x) 왜곡된 층상구조나 암염 구조로 변형되고, 전기화학적 특성이 감소한다. 층상구조로 이루어진 양극재의 왜곡된 구조나 암염 구조로의 구조 변이는 양극재의 전기화학적 특성을 치명적으로 악화시키기 때문에 가장 중점적으로 해결해야 할 문제이다.[44] 이러한 양이온 이동으로 인해 일어나는 층상 구조의 왜곡이나 암염 구조로의 변화는 양극재의 화학적 조성을 변화시키거나 상한 컷오프 전압의 조정 혹은 다른 원소의 도핑, 코팅을 통하여 구조 변화를 완화할 수 있다.
두 번째 요인은 층 내 혹은 층 간 전이금속의 이동으로 인한 문제이다(Fig. 7.b). 전이금속이 층상 구조에서 원래 위치해야 할 곳에서 벗어나 소듐이온이 존재하는 층으로 이동하거나 방출되면 전이금속 층의 공극이 존재하게 되고, 양이온의 산화 환원으로 인해서 점진적인 용량 감소로 이어져 전기화학적 성능의 감소로 이어지게 된다.
세 번째 요인은 반 데르 발스(van der Waals), 산소층과 산소층 간의 반발력 그리고 산소와 소듐 사이의 인력 등 정전기적으로 상호작용하는 힘 간 균형의 변화로 인한 문제이다. 이러한 경우 층상 구조가 P형에서 O형 구조로 상전이가 발생하게 된다(Fig. 7.c). P형 NaTMO2는 보통 P형에서 O형으로 구조적 변화가 일어나는데, 이러한 상전이는 큰 부피 변화를 일으키고, 빠른 구조적 열화를 발생시키며, 결국 용량 감소로 이어지게 된다. P형에서 O형으로의 상전이도 마찬가지로 다른 원소의 도핑이나 코팅을 통해 상전이를 억제하여 구조적 변화와 변화로 인한 전기화학적 성능의 감소를 어느 정도 완화가 가능하다.
층상 구조 양극재 내에서의 산소 원자가 손실되는 문제도 구조적 붕괴를 일으키는 요인 중 하나이다. 산소 원자는 양극재 내에서 close-packing 되어있어 층상 구조의 기본 틀이 되는데 산소 원자가 손실되게 되면 구조적 붕괴가 일어난다. 또한 높은 작동 전위에서 NaTMO2의 표면 산소 이온은 매우 활성화되는데, 활성화된 산소 이온은 맞닿아 있는 전해질과 반응하여 O2 가스를 생성하며 방출되는 문제도 존재한다. Table 1에 서로 다른 산화 환원 쌍의 전기화학적 가역성과 주로 일어나는 구조적 변형을 요약하였다. 전기화학적 특성과 구조적 특성은 주요 산화/환원 활성 원소에만 의존하는 것이 아니라 다른 이온과의 상호 작용에도 영향을 받는다. 결론적으로, 대부분의 양극재에서 일어나는 구조적 변형은 화학 조성을 조절하고, 코팅이나 도핑 등을 통해 산화/환원 불활성 이온을 도입하여 층간 간격을 조절함으로써 완화될 수 있다.[40]
7. 결론
지각 내 원자재의 풍부한 매장량과 저렴한 가격은 소듐이온 배터리를 리튬이온 배터리에 이은 차세대 이차전지로 주목받게 하는 주된 요인이다. 그러나 소듐이온 배터리는 리튬이온 배터리에 비해 낮은 용량, 율속 특성, 에너지 밀도 및 수명 특성 등의 한계를 가진다. 이를 극복하기 위한 연구개발이 활발히 이루어지고 있다. 소듐이온 배터리용 양극재 연구는 층상구조 전이금속 산화물, 다중음이온 화합물, 프러시안 블루 유사체 등 다양한 방향으로 진행되고 있으며, 특히 층상구조 전이금속 산화물이 유망하다고 평가된다. 리튬이온 배터리의 양극재와 마찬가지로 층상구조 전이금속 산화물은 대량 생산 가능하며, 균일한 입자를 얻을 수 있는 공침법으로 합성될 수 있는 장점을 지닌다. 이는 소듐이온 배터리 합성에도 그대로 적용될 수 있다는 이점을 제공한다.
층상구조 양극재는 넓고 용이한 소듐이온 확산 경로를 통해 뛰어난 에너지 밀도와 초기용량 같은 전기화학적 특성을 제공한다. 그러나 소듐이온의 삽입과 추출 과정에서 발생할 수 있는 불필요하고 복잡한 상전이 과정은 전기화학적 특성에 부정적 영향을 미친다. 이러한 문제를 해결하기 위해 다른 원소의 도핑이나 코팅과 같은 방법을 통한 연구개발이 필수적인 것으로 보인다. 위에서 언급한 몇 가지 문제들을 해결한다면 소듐이온 배터리는 리튬이온 배터리를 대체할 수 있는 차세대 이차전지로의 충분한 성장 가능성을 지니고 있다고 여겨진다.
ACKNOWLEDGEMENTS
본 논문(결과물)은 2023학년도 명지대학교 신임교원 연구비 지원사업의 결과입니다.
References
Biography

⊙⊙ 이 승 현
⊙ 2023년 국립안동대학교 신소재공학부 학사
⊙ 2024년 명지대학교 신소재공학과 석사과정

⊙⊙ 남 승 훈
⊙ 2014년 서울대학교 재료공학부 박사
⊙ 2014년 삼성전자 종합기술원 전문연구원
⊙ 2015년 한국기계연구원 선임연구원
⊙ 2019년 국립안동대학교 신소재공학부 조교수
⊙ 2023년 명지대학교 신소재공학과 부교수