서론
화석연료의 사용으로 인한 자원 고갈 및 환경오염 문제가 야기되면서 화석연료를 대체할 신재생 에너지 개발의 필요성이 증대되고 있다. 여러 신재생 에너지원 중 수소는 풍부한 물로부터 제조될 수 있고, 에너지 밀도가 높으며 (수소 143 MJ/kg, 천연가스 54 MJ/kg, 석탄 24 MJ/kg), 온실가스인 이산화탄소 배출 없이 높은 에너지 변환 효율을 나타내기 때문에 지속 가능한 에너지원으로 주목 받고 있다. 따라서 다가올 수소 경제에 대비한 수소에너지의 생산, 저장 및 이용 관련 기술 개발이 필수적이며, 특히 수소 생산 기술의 경쟁력 확보가 매우 중요한 시점이다.1–4) 다양한 수소 생산 방법 중 태양광과 (혹은 풍력) 연계한 형태의 수전해 시스템(물 전기분해, Water splitting)은 물을 공급 원료로 사용하여 온실가스 및 오염물질을 배출하지 않고 수소를 생산하는 청정한 수소 생산 시스템으로 장기적인 관점에서 연구가 진행되고 있다.5–7)
물 전기분해가 일어나는 전해조는 수소 발생 반응(Hydrogen Evolution Reaction, HER)과 산소 발생 반응(Oxygen Evolution Reaction, OER)이 일어나는 수소극(cathode)과 산소극(anode)으로 구성되어 있다. 물 전기분해를 위해 외부 전압이 양 전극에 인가되면 물 분자는 수소와 산소로 분해되며, 이때 전체 반응식은 다음과 같이 표현된다.
표준상태 T, P 조건(T = 298.15 K, P = 1 atm)에서 전기화학 반응이 일어나기 위해서는 1.23 V의 전압을 가해주어야 한다. 하지만 실제 작동 전압(E op)은 1.23 V 에 초과 전압이 더해지는데 이를 과전압(overpotential, η)이라고 하며 다음과 같이 나타낼 수 있다.
과전압은 anode(η a)와 cathode(η c)에 존재하는 고유한 활성화 장벽뿐만 아니라 전해질이나 회로에서 발생하는 저항(η other)을 극복하기 위해 필요하다. 따라서 물 전기 분해 효율을 높이기 위해서 과전압을 줄이는 것이 중요하며, 특히 η a와 η c는 촉매를 사용하여 줄일 수 있기 때문에 활성이 좋은 촉매일수록 과전압을 크게 줄일 수 있다.5)
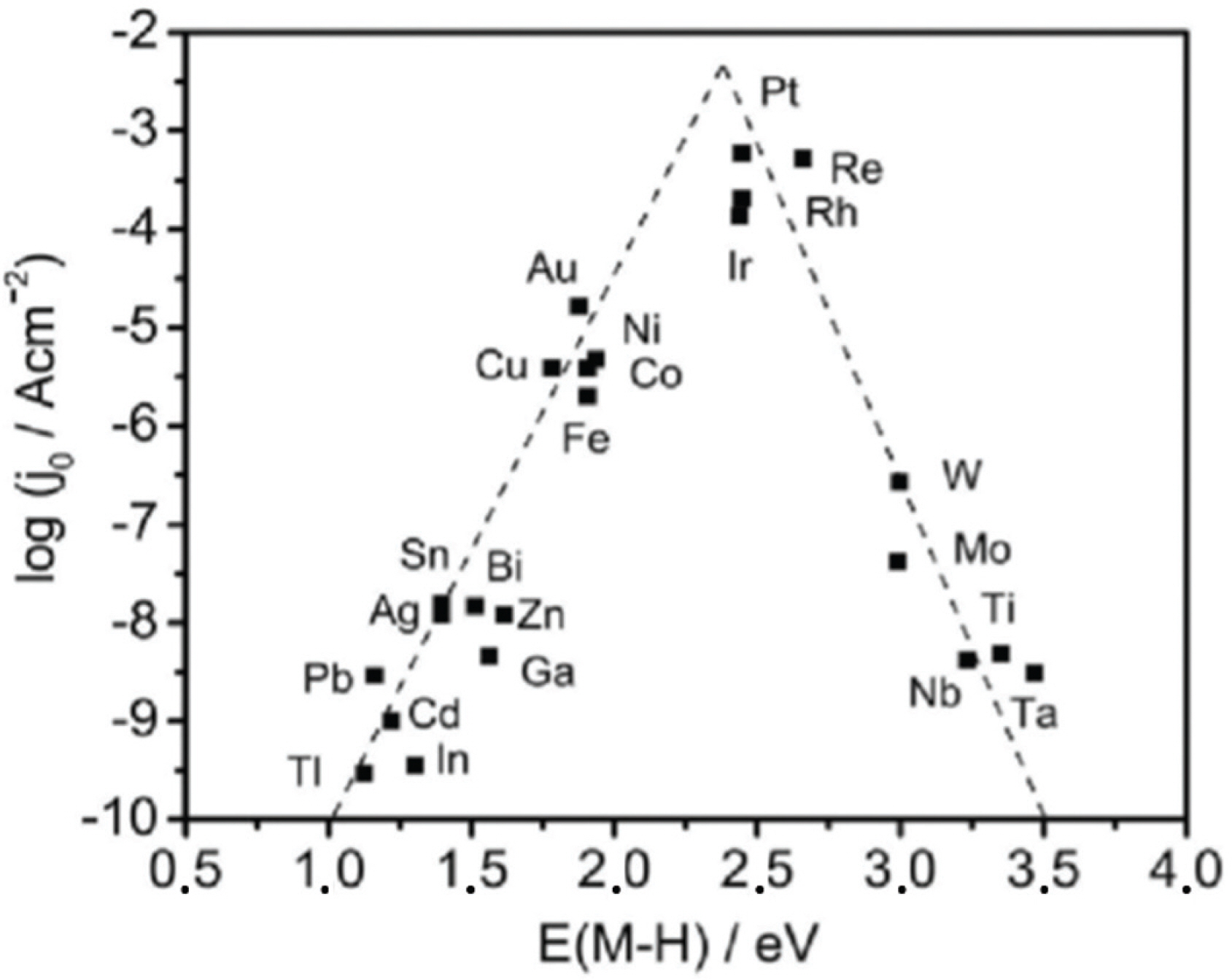
수소 발생 반응에서 촉매의 활성을 나타내는 중요한 지표는 수소 결합 에너지(Hydrogen Binding Energy, HBE)이다. 이를 잘 나타내는 그래프가 HBE와 교환전류밀도로 도시한 volcano plot이다. (Fig. 1) Sabatier 원칙에 근거하여 너무 강하거나 너무 약한 HBE는 전체 반응에 유리하지 않다. 너무 강한 HBE는 생성물(수소)의 탈착이 어렵고, 너무 약한 HBE는 전하전달이 잘 일어나지 않는다.8,9) 따라서 적당한 HBE를 가지며 높은 전류 밀도를 나타내는 백금(Pt)은 volcano plot의 꼭지점 부근에 위치하여 활성이 가장 좋은 수소 발생 촉매로 알려져 있다. 하지만 귀금속인 백금은 한정된 매장량으로 인한 비싼 가격 문제가 있기 때문에 실제 상용화에는 한계가 존재한다. 따라서 백금을 대체하기 위한 저가의 비귀금속 기반 신규 촉매 개발이 필수적이다.
Table 1.
Reaction of water splitting in acid and alkaline media.
| Acid | Alkaline | |
|---|---|---|
| Total reaction | H2O → H2 + ½O2 | |
| Cathode | 2H++2e– → H2 | 2H2O+ + 2e– → H2 + 2OH– |
| Anode | H2O → 2H+ + ½O2 + 2e– | 2OH– → H2O + ½O2 + 2e– |
전이금속 질소화물(Transition Metal Nitrides, TMNs)은 전이금속 격자 내에 질소 원자가 도입되어 생 긴 화합물로써 원래의 금속과는 전혀 다른 특성을 지니며 특히 융점, 경도, 내마모성, 초전도성, 그리고 부식 저항성과 같은 우수한 물리적 특성을 지녀 절삭 공구 및 내화물용 코팅제로 사용되었다.10,11) 또한, 귀금속과 유사한 전자구조를 나타내어 수첨공정 및 수첨탈황공정과 같은 화학 공정 분야에서 귀금속 촉매의 대체 촉매로 연구가 진행되었다.12–14) 최근에는 HER, OER 반응뿐 아니라,15) 산소 환원 반응(Oxygen Reduction Reaction, ORR), 메탄올 산화 반응(Methanol Oxidation Reaction, MOR) 등의 전기화학 반응에서 전이금속 질소화물 촉매가 폭넒게 연구되고 있다.16–19) 특히 HER 분야에서는 MoN,20) Mo2 N,21) Ni3 N,22) CoN,23) TiN,24) TaN,25) Ta3 N526)과 같은 물질들이 촉매 활성을 나타내는 것으로 보고되고 있다.
이러한 전이금속 질소화물 기반 촉매의 활성을 증가시키기 위해 나노구조화 또는 탄소 소재와의 복합화 형태의 질소화물이 보고되고 있으나, 기존의 탄소화물(carbide), 인화물(phosphide), 황화물(sulfide) 기반 촉매보다 수소 생산 활성이 낮은 실정이다. 이러한 한계를 극복하기 위해 최근 두 종류의 전이금속으로 구성된 바이메탈릭 전이금속 질소화물 (Bimetallic Transition Metal Nitride)이 주목을 받고 있다. 바이메탈릭 촉매는 두 전이금속 사이의 시너지 효과로 인해 단일 금속 (Monometallic) 촉매 보다 향상된 HER 촉매 활성을 가지는 것으로 알려져 있다.27–29) 바이메탈릭 촉매에서 두 금속의 존재는 더 풍부한 활성점과 향상된 전자 전도도를 제공할 수 있어 전기화학 반응에 유리하다. 또한, 바이메탈릭 촉매는 금속 양이온의 원소 조성 비율을 조절하여 전자 구조를 조절할 수 있기 때문에 촉매의 물리·화학적 특성을 향상시킬 수 있는 잠재력을 지닌다.29,30) 따라서 본 논문에서는 HER 촉매로써 사용된 바이메탈릭 전이금속 질소화물 연구 사례를 소개하고자 한다.
본론
2.1 Nickel Molybdenum Nitride
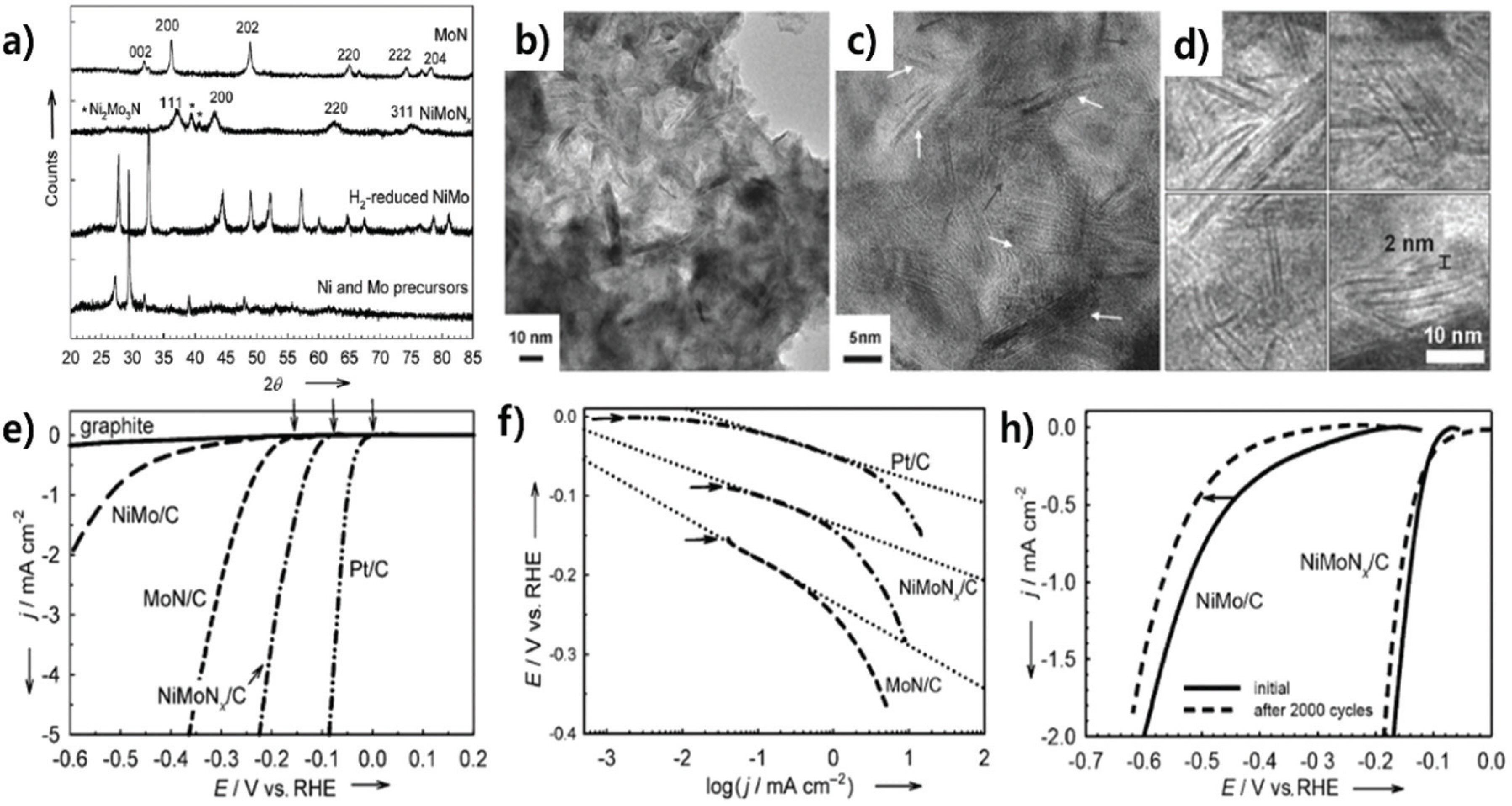
Ni과 Mo의 도입으로 형성한 Ni-Mo-N 물질은 높은 HER 활성을 나타내는 대표적인 바이메탈릭 전이금속 질소화물이다. 효율적인 물 분해 능력을 갖춘 Ni과 강한 수소 결합에너지를 나타내는 Mo의 시너지 효과는 HER 활성 향상에 기여할 수 있기 때문에 많은 연구가 진행되고 있다.28,31) Ni-Mo-N 촉매의 HER 활성은 Sasaki 그룹에 의해 최초로 제시되었다.32) Ni, Mo 전구체를 H2와 NH3로 환원 및 질화 시켜 Mo2 N과 Ni2 Mo3 N이 혼재한 나노 시트 형태의 NiMoN x를 탄소 지지체에 (NiMoN x/ C) 제조하였다. (Fig. 2a) NiMoN x 나노 시트는 얇고 평평한 스택 구조를 보이며, 최대 2 nm의 간격의 단일 시트 형태로 존재하였다. (Fig. 2b-d) 0.1 M HClO4 전해질 조건에서 NiMoN x/C 촉매는 78 mV의 낮은 개시전압과 35.9 mV/dec의 낮은 타펠 기울기를 나타내어 monometallic nitride (MoN/C, Mo2 N/C) 촉매보다 월등히 뛰어난 HER 활성과 안정성을 나타내었다. (Fig. 2e-h) Ni의 도입으로 낮아진 Mo의 d-band center가 수소 흡착 에너지를 낮추어 흡착된 수소의 재결합을 원활하게 하였고, 결과적으로 NiMoN x 촉매의 HER 활성이 증가한 것으로 제시되었다.
최근 Ni0.2 Mo0.8 N 형태의 Ni-Mo-N 촉매들이 HER 에 활발히 적용되고 있다. 대부분의 Ni0.2Mo0.8N 촉매는 수열합성을 통해 바이메탈릭 산화물을 합성하고 이어서 NH3를 이용한 질화 과정을 통해 Ni0.2 Mo0.8 N를 합성하는 2단계 열처리 방식으로 제조되었다. Chen 그룹은 Ni foam substrate 위에 Ni-Mo-N nanowires(NiMoN/ NF)가 성장한 형태의 HER 촉매를 개발하였다.33) Ni, Mo 전구체와 Ni foam을 수열합성하여 Ni foam 위에 NiMoO 4를 성장시키고 (NiMoO4/NF), NH3 분위기에서 300 ∼ 600 ℃에서 열처리하여 Ni3 N과 Ni0.2 Mo0.8 N 가 혼재된 촉매를 제조하였다. 제조된 NiMoN/NF 촉매는 지름 50∼100 nm의 나노 와이어 형태를 보이며, 열처리 온도가 상승할수록 Ni0.2 Mo0.8 N phase가 증가하는 것으로 나타났다. Substrate로 사용된 Ni foam은 높은 전기 전도도와 다공성 계층 구조를 지니기 때문에 전자 흐름 경로를 제공하고 촉매 활성점과 전해질의 상호작용을 향상시킬 수 있다.34,35) 450 ℃에서 열처리한 NiMoN/NF-450 촉매가 1 M KOH 전해질 조건에서 가장 높은 HER 활성을 나타내었다. 전류 밀도 10 mA/ cm2에 도달하는 데 필요한 과전압(η10) 22 mV를 기록하며 Pt/C에 근접한 매우 우수한 HER 활성을 기록하였으며 20 시간 작동에서 높은 내구성을 보였다. Ni foam 위에 Ni0.2 Mo0.8 N를 직접 성장시켰기 때문에 binder가 필요 없으며, 전해질과 더 많은 활성점이 반응하는 것이 높은 활성의 원인으로 제시되었다.
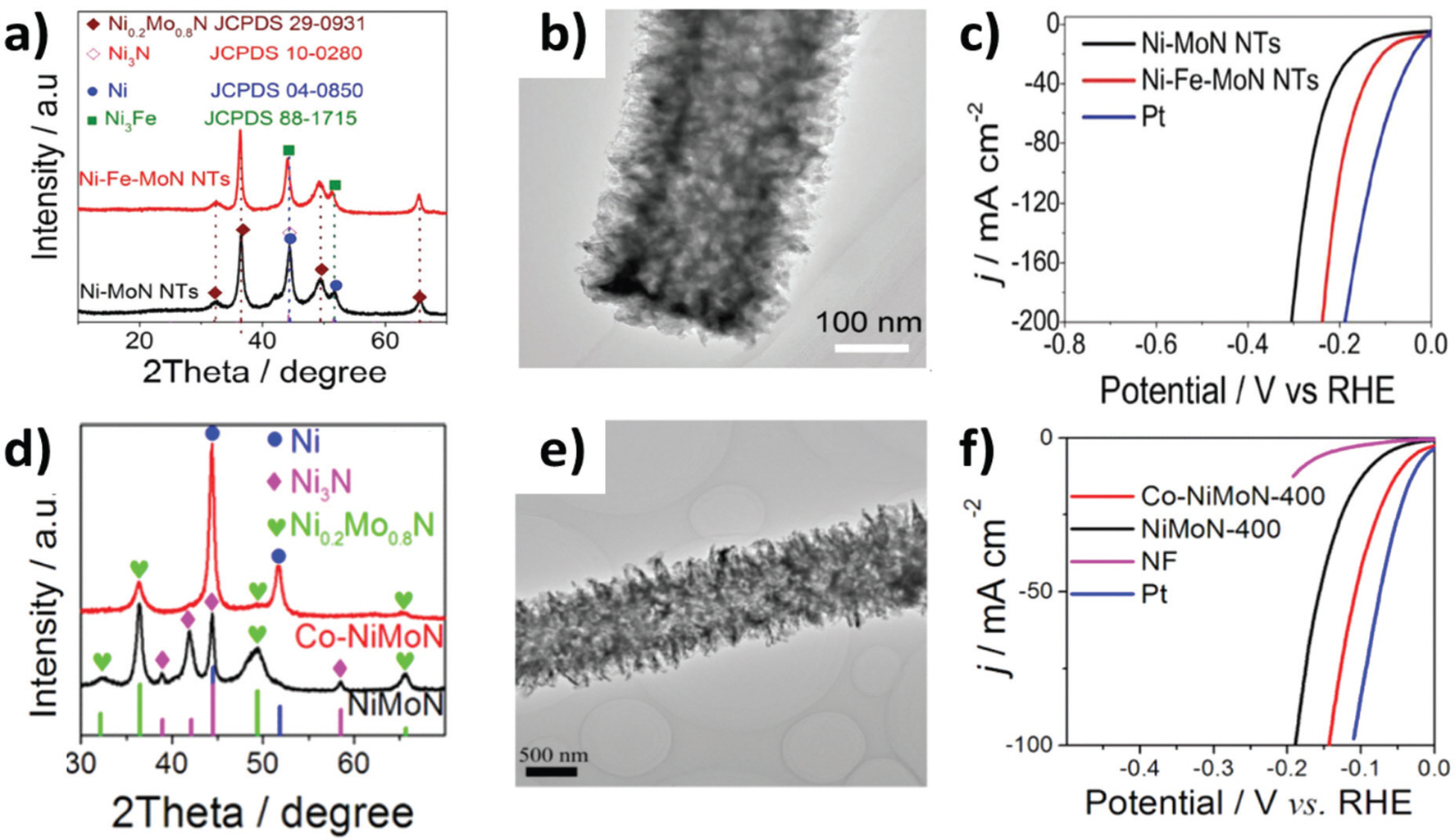
제 3의 전이금속을 도펀트로 사용하여 Ni-Mo-N 촉매의 활성을 극대화한 연구사례도 보고되고 있다.36–39) Chen 그룹은 core-shell 구조의 MoO3@Ni(OH)2 나노 튜브(nanotube, NT)에 Fe를 첨가하여 상온에서 교반 후 NH3 분위기에서 열처리하여 다공성 계층 구조의 3차원 Ni-Fe-MoN NTs촉매를 합성하였다.36) Fe가 도핑 되면서 격자 간 거리의 증가를 유도하여 Ni-Fe-MoN 의 Ni0.2Mo0.8N peak 위치가 낮은 회절 각으로 이동하였다. 따라서 제조된 Ni-Fe-MoN 촉매는 Fe-doped Ni0.2 Mo0.8 N와 Ni3 Fe 결정 구조로 구성되어 있음을 알 수 있다. (Fig. 3a) Ni-Fe-MoN NTs의 지름은 약 300 nm, 나노 튜브의 두께는 약 80 nm로 관찰되었으며 외부 벽은 많은 나노 시트 구조로 형성된 다공성 구조를 보인다. (Fig. 3b) 1 M KOH 전해질 조건에서 Ni-Fe-MoN NTs 촉매는 55 mV의 η10값을 기록하며 Ni-MoN NTs 촉매보다 뛰어난 HER 활성 및 안정성을 나타내었다. (Fig. 3c) Fe의 도입이 Ni 원자의 전자 구조 변형을 이끌어 내어 전하 전달 저항을 감소시켰으며 또한, Ni-Fe-MoN NTs의 다공성 관형 특징은 안쪽과 바깥쪽 표면을 포함한 넓은 표면적을 제공하여 활성점과 전해질 접촉을 증가시켰다. 따라서 Ni-Fe-MoN NTs의 뛰어난 HER 활성은 Fe 도입과 3차원 다공성 관형 구조에서 기인한 것으로 나타났다. 이와 비슷한 방법으로 MoO3 nanowire(NR)에 Co를 도입하여 수열합성법과 NH3를 이용한 질화 과정을 통해 Co가 도핑된 다공성 NiMoN NRs(Co-NiMoN NRs)가 제조되었다.37) 이전 연구와 마찬가지로 NiMoN NRs 촉매는 Ni0.2 Mo0.8 N과 Ni3 N으로 구성되었으나 Co 도입 후에는 Ni3 N가 사라지고 Ni0.2 Mo0.8 N과 Ni/Co 혹은 CoNi alloy phase가 나 타난 것을 알 수 있다. (Fig. 3d-e) 1 M KOH 전해질에서 NiMoN NRs은 90 mV의 η10값을 기록한 반면, Co-NiMoN NRs은 η10 45mV을 나타내어 Co 도핑이 HER 활성 향상에 기여한 것을 알 수 있다. Co-NiMoN NRs 의 격자 왜곡 및 비정질/결정질 계면과 같은 많은 결함이 촉매의 활성점을 많이 생성한 것으로 제시되었다. (Fig. 3f)
Fig. 3.
a) XRD patterns, b) TEM images and c) The polarization curves (1 M KOH) for Ni-Fe-MoN NTs HER catalyst.36) Reproduced from Zhu et al. Adv. Energy Mater. 2018; 8: 1802327, with permission of Wiley.36) c) XRD patterns, e) TEM images and f) The polarization curves (1 M KOH) for Co-NiMoN NRs HER catalyst.37) Reproduced from Yin et al. ACS Appl. Mater. Interfaces 2019; 11: 27751–9, with permission of American Chemical Society.37)
Huang 그룹은 vanadium을 도입하여 Ni0.2 Mo0.8 N 의 HER 활성을 극대화한 V-Ni0.2Mo0.8N을 개발하였다.38) Ni foam과 Ni, Mo, V 전구체를 수열 합성하여 V-NiMoO4/NF 전구체를 제조하고, NH3를 이용한 질화 과정을 거쳐 V-Ni0.2 Mo0.8 N 촉매를 합성하였다. 이렇게 생성된 V-Ni0.2 Mo0.8 N는 Ni foam에 해당하는 Ni 금속과 단일상 Ni0.2 Mo0.8 N으로 구성되어 있으며, V 도핑으로 격자 간격이 감소하여 XRD peak가 pure Ni0.2 Mo0.8 N보다 높은 회절 각으로 위치하였다. 또한, V-Ni0.2 Mo0.8 N의 80 ∼ 100 nm 지름의 nanowire 는 수많은 작은 나노 입자들로 구성되어있다. 1 M KOH 전해질에서 V-Ni0.2 Mo0.8 N 촉매는 Ni0.2 Mo0.8 N 촉매보다 약 40 mV 낮은 39 mV의 η10값을 기록하였고, 200 mA/cm2의 고전류밀도에서 178 mV의 과전압을 기록하며 우수한 HER 활성을 나타내었다. 밀도범함수이론 기반 계산에서 V-Ni0.2 Mo0.8 N(0.56 eV)은 pure Ni0.2 Mo0.8 N(0.86 eV)에 비해 더 낮은 물 분해 에너지 장벽을 나타냈다. V 도핑은 Ni0.2 Mo0.8 N 표면에 흡착된 물 분자를 분해하여 H*(촉매 표면에 흡착된 수소 원자)의 형성을 촉진하기 때문에 Volmer step(H2 O + e− → H* + OH−)을 더욱 원활히 일어나게 한다. HER 활성을 나타내는 중요한 지표인 수소 흡착 에너지(ΔG H*)는 열 중성 조건(ΔG H* = 0)에 근접할수록 이상적인 수소 흡·탈착 능력을 나타낸다.40) V-Ni0.2 Mo0.8 N(−0.27 eV)의 ΔG H*는 Ni0.2 Mo0.8 N(−0.71 eV)보다 열 중성 조건에 가깝기 때문에 V 도핑이 수소 흡·탈착을 원활하게 하여 HER 활성을 강화하는 요인이라고 설명하였다.
기존의 Ni0.2 Mo0.8 N와 다른 구조를 지니는 Ni2 Mo3 N 촉매 역시 높은 HER 활성을 보이는 Ni-Mo-N의 하나로 최근 보고되었다. Huang 그룹은 Ni0.2 Mo0.8 N 합성법에서 NH3 가스 대신 Ar/N2/H2 혼합 가스를 사용하여 V-Ni2 Mo3 N 촉매를 합성하였다.39) Ni2 Mo3 N 촉매 (η10 = 101 mV, η100 = 230 mV)는 Ni0.2 Mo0.8 N 촉매(η10 = 108 mV, η100 = 250 mV)보다 뛰어난 HER 활성을 나타내었으며, V 도핑 후에 V-Ni2 Mo3 N의 HER 활성(η10 = 54 mV, η100 = 117 mV)은 더욱 증가하였다. 또한, V-Ni2 Mo3 N 촉매의 Mo site(−0.93 eV), N site(−0.15 eV)는 Ni2 Mo3 N 촉매의 Mo site(−1.02 eV), N site(−0.19 eV)보다 열 중성 조건에 가까운 ΔG H*값을 나타내어 V 도핑이 HER 활성을 강화하는 요인인 것을 밝혔다. Youn 연구진에서는 기존 Ni-Mo-N 촉매 합성법의 2단계 열처리와 유독성 가스(NH3)사용이라는 단점을 극복한 간단하고 경제적인 Ni-Mo-N 합성법을 개발하였다.41) Mo-urea 용액을 Ni foam과 함께 질소 흐름 하에서 동시에 열처리하여 Ni2 Mo3 N/NF 촉매를 합성하였다. (Fig. 4a) Urea를 질소원으로 사용하여 NH3 사용을 피했고, 열처리 과정 중 Ni foam이 Ni 원료로 사용되어 추가 Ni 첨가가 필요하지 않아 안전하고 경제적이라는 장점이 있다. 제조된 Ni2 Mo3 N/NF는 Ni foam 위에 단일상 Ni2 Mo3 N이 성장하였으며, 평균 입자 크기 약 7 nm의 나노 입자로 구성되어 있다. (Fig. 4b-c) 1 M KOH 전해질 조건에서 Ni2 Mo3 N/NF 촉매는 10, 50, 100 mA/cm2에 도달하는데 21.3, 89, 123.8 mV의 과전압을 나타내어 매우 우수한 HER 활성을 보유하였다. (Fig. 4d) 본 연구진은 Ni2 Mo3 N/NF 촉매의 HER 활성점을 규명하기 위해 실시한 밀도범함수이론 계산을 통해 N 활성점의 구조적 특성이 HER 활성에 큰 영향을 미치는 것을 확인하였다. 특히 특정 N site(N-Mo coordination number = 4)에서 열 중성 조건에 가장 가까운 ΔG H*값(평균 −0.07 eV)을 나타내는 것을 확인하였다. (Fig. 4e)
Fig. 4.
a) Schematic illustration of the synthetic method for Ni2 Mo3 N/NF. b) XRD patterns, c) TEM image and d) The polarization curves (1 M KOH) for Ni2 Mo3 N/NF. e) DFT results for overall H-adsorption strength trend with respect to coordination number(CN) of N-Mo bonding.41) Reproduced from Park et al. J. Mater. Chem. A 2021; 9: 4945–51, with permission of Royal Society of Chemistry.41)

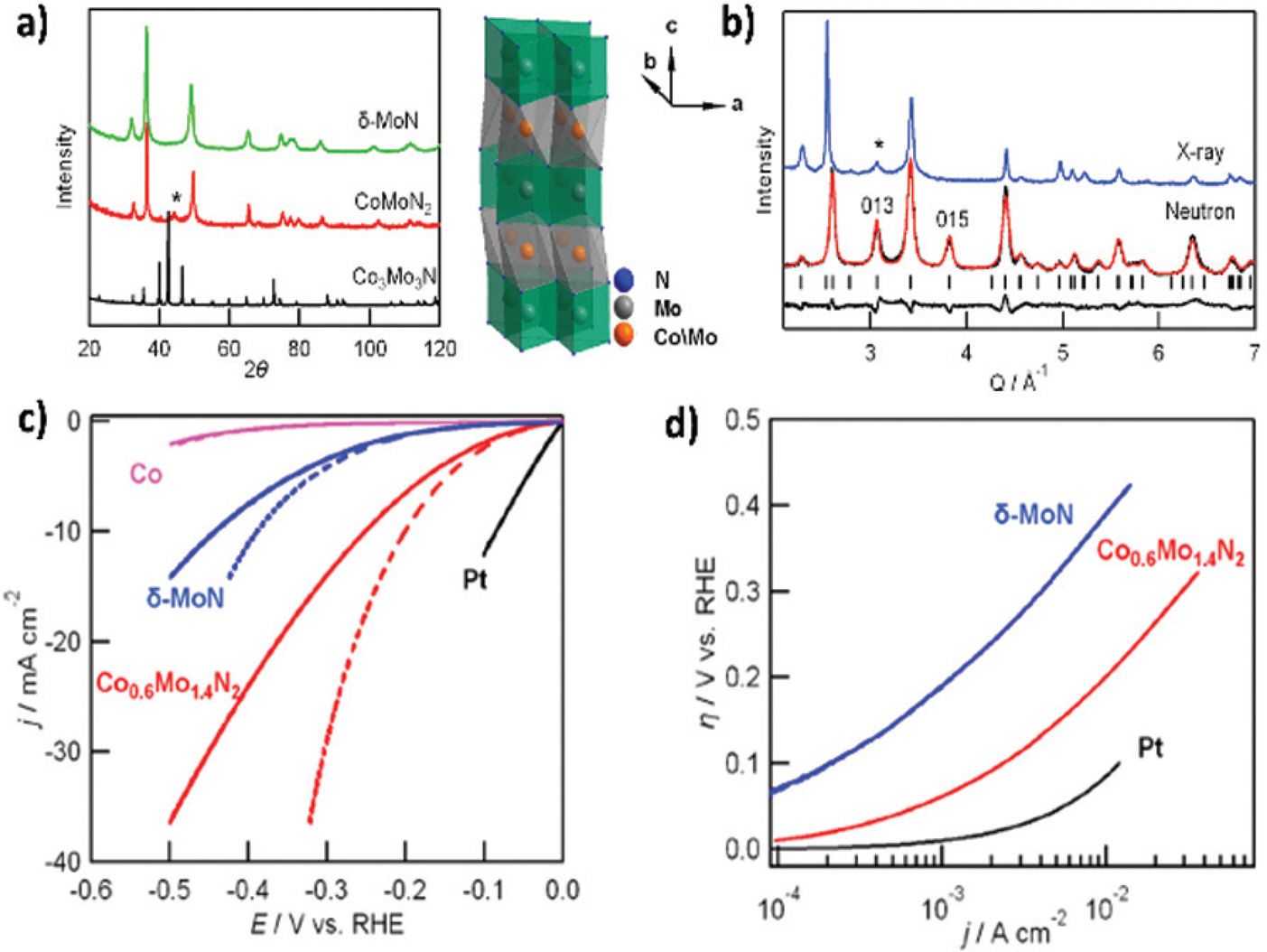
2.2 Cobalt Molybdenum Nitride
Khalifah 그룹은 상대적으로 낮은 MoN의 고유 HER 활성을 개선하기 위해 Co를 도핑 하여 mixed close-packed cobalt molybdenum nitride 촉매를 개발하 였다.42) CoMoO4 전구체를 NH3 흐름 하에서 열처리하여 Co0.6 Mo1.4 N2 촉매를 합성하였다. Neutron powder diffraction을 통해 Co(Ⅱ)와 Mo(Ⅲ)가 차지하는 octahedral sites와 Mo(Ⅲ∼Ⅳ)가 위치하는 trigonal-prismatic sites가 교대로 층이 있는 4-layered mixed closed packed 구조임을 확인하였다. (Fig. 5a-b) 0.1 M HClO4 전해질 조건에서 Co0.6 Mo1.4 N2 촉매는 10 mA/ cm2 전류밀도에 도달하는데 200 mV의 과전압을 기록하며 MoN 촉매보다 향상된 HER 활성을 나타내었다. (Fig. 5c-d)
Fig. 5.
a) XRD patterns and 4-layerd crystal structure of CoMoN2. b) Rietveld refinements of neutron diffraction for CoMoN2. c-d) The polarization curves and Tafel plots (0.1 M HClO4) for Co0.6 Mo1.4 N2.42) Reproduced from Cao et al. J. Am. Chem. Soc. 2015; 137: 9927–36, with permission of American Chemical Society.42)
2.3 Nickel Iron Nitride
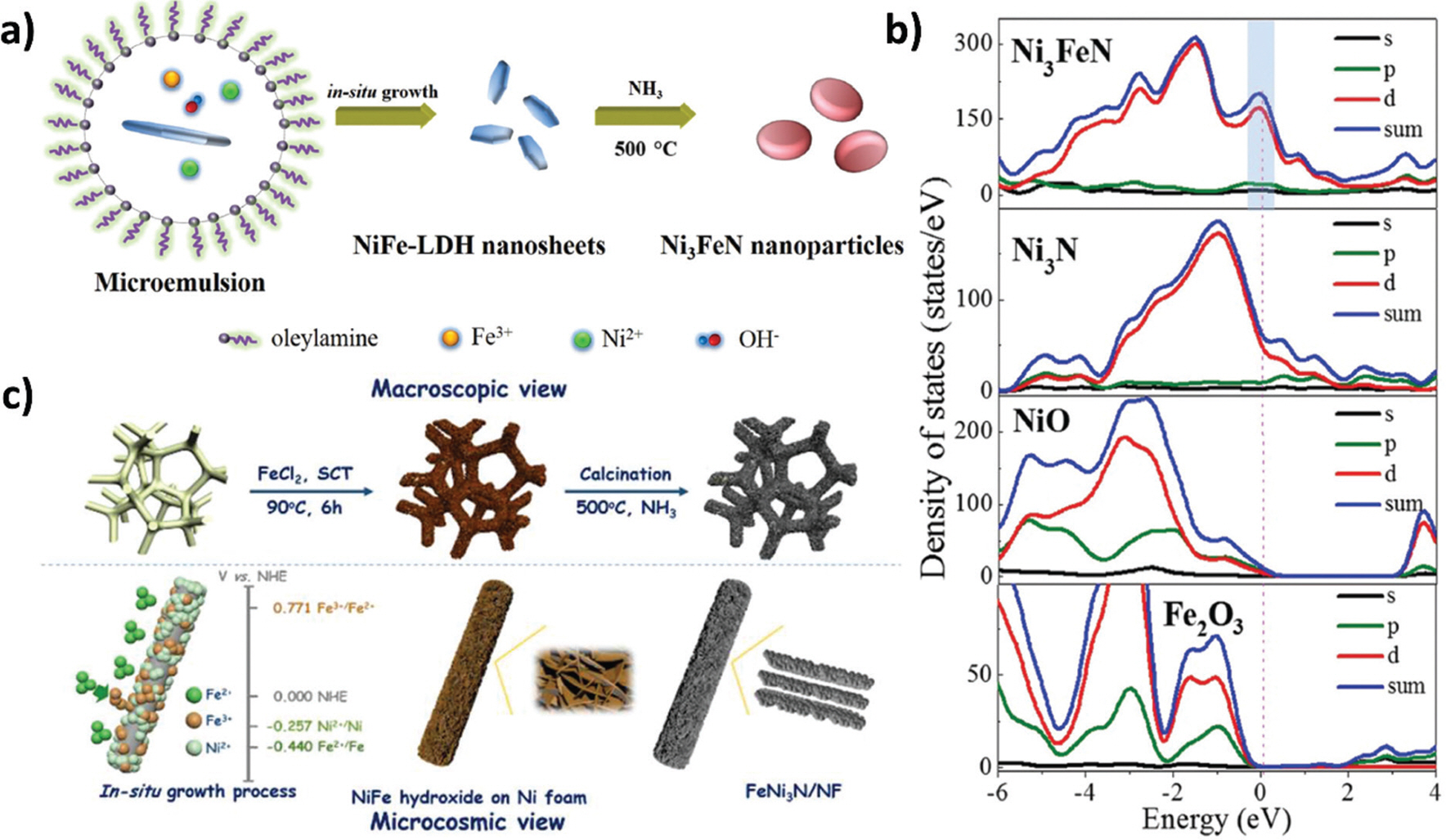
Ni-Fe alloy는 고활성의 물 전기분해 촉매로 많은 연구가 진행된 물질 중 하나이며, 이의 질화 형태인 Ni-Fe-N 촉매도 최근 많은 연구가 진행되고 있다.29,43,44) Zhang 그룹은 reverse microemulsion method를 사용하여 제조한 초박형 NiFe-LDH (Layered Double Hydroxide) 나노 시트 전구체를 NH3를 이용한 질화 과정을 통해 Ni3 FeN-NPs를 합성하였다. (Fig. 6a)45) 이렇게 제조된 Ni3 FeN-NPs는 약 100 nm의 입자 크기와 약 9 nm 두께를 나타내었다. 1 M KOH 전해질 조건에서 Ni3 FeN-NPs 촉매는 10, 100 mA/cm2에서 과전압 158, 416 mV를 기록하였으며, 특히 과전압 343 mV 이상 전압 범위에서 Pt/C보다 높은 전류 밀도를 나타내 우수한 HER 활성을 나타냈다. Fermi level 근처의 Ni3 FeN의 밴드 구조 및 density of state(DOS)가 뚜렷한 간격 없이 연속적이므로 Ni3 FeN이 금속 특성을 보유하여 뛰어난 전기 전도도와 전자 전달 능력을 갖춘 것으로 제시되었다. (Fig. 6b) 이와 비슷한 시도로, Ni3 Fe LDH 전구체를 질화하여 제조한 nanoparticles-stacked porous Ni3 FeN (NSP-Ni3 FeN) 촉매가 Wang 그룹에 의해 보고되었다.46) LDH 전구체의 층상 구조를 유지한 Ni3 FeN 나노 시트는 20 ∼ 30 nm 크기의 나노 입자들로 구성되어 있기 때문에 활성점의 노출을 증가 시켜 향상된 HER 활성을 보였다.
Fig. 6.
a) Schematic illustration of the formation of Ni3 FeN nanoparticles. b) Total and partial electronic density of state calculated for Ni3 FeN, Ni3 N, NiO, and Fe2 O3.45) Reproduced from Waterhouse et al. Adv. Energy. Mater. 2016; 6: 1502585, with permission of Wiley.45) c) Schematic illustration of the formation of FeNi3 N/NF.47) Reproduced from Zhang et al. Chem. Mater. 2016; 28: 6934–41, with permission of American Chemical Society.47)
Ni foam, carbon cloth와 같은 전도성 기판에 촉매를 직접 성장시킨 Ni-Fe-N 촉매는 기존 분말 촉매에 비해 전기 전도도가 높고 우수한 기계적 특성을 보인다. 47,48) Xiao 그룹은 간단한 화학 침전 반응을 통해 Ni foam 위에 NiFe(OH) x 나노 시트를 성장시킨 뒤, 질화 열처리하여 FeNi3 N/NF 촉매를 합성하였다. (Fig. 6c)47) 합성 과정에서 전극 기판으로 사용된 Ni foam은 Fe 전구체(Fe3+)의 redox etching에 의해서 느리게 방출되는 Ni 전구체 역할을 하였기 때문에, 추가적인 산화제나 Ni 전구체가 필요 없는 장점이 있다. 가열 용액에서 Fe2+는 Ni과 반응하지 않고 산소와 물과 반응하여 Fe3+로 산화되고 (반응식 1), Ni foam은 생성된 Fe3+에 의해 redox-etched 되어 Ni 이온을 서서히 방출시킨다. (반응식 2) 이때, Ni2+와 Fe3+가 Ni foam위에 침전되어 NiFe 수산화물을 형성한다고 보고하였다. (반응식 3)
1. 4Fe2+ + O2 + 2H2O ↔ 4Fe3+ + 4OH−
2. 2Fe3+ + Ni → 2Fe2+ + Ni2+
3. xNi2+ + Fe3+ + (2× +3)OH− → NixFeOH2x+3
FeNi3 N/NF 촉매는 낮은 과전압(η10 = 75 mV)과 타펠 기울기(98 mV/dec)를 나타내었으며, 특히 400 시간 이상 안정성을 유지하여 뛰어난 HER 활성을 보유한 것으로 나타났다.
2.4 Nickel Cobalt Nitride
Zhang 그룹은 전기 증착법을 통해서 Ni foam 위에 성장한 Ni-Co 수산화물 전구체를 제조하고, 이를 NH3 열처리하여 다공성 nickel cobalt nitride (NiCo2 N) 나노 시트를 합성하였다.49) 3-전극 시스템에서 수행된 전기 증착 공정은 각각 Ni foam, Ag/AgCl, Pt plate를 작업 전극, 기준 전극, 상대 전극으로 사용하였다. 전해질은 Ni2+/Co2+ 몰 비율 1:2로 녹아 있는 50 mL (0.1 M) 용액을 사용하여 −0.1 V에서 10분간 전기 증착을 실시하였다. (Fig. 7a) 다공성 구조의 NiCo2 N 나노 시트는 Ni foam 위에 수직으로 성장하였으며, 이러한 다공성 나노 시트가 서로 연결되어 거품과 같은 연속 구조체를 형성하여 기계적 안정성을 향상시켰다. 1 M KOH 전해질에서 실시한 전기화학 실험에서 NiCo2 N-NF 촉매는 다른 촉매에 비해 뛰어난 HER 활성(η10 = 180 mV)을 나타내었다. (Fig. 7b)
금속-유기 구조체(Metal-Organic Framework, MOF)의 직접 열처리는 균일한 전이금속 기반 복합재를 제조하기 위한 효과적인 방식으로 알려져 있다.50–53) MOF-74-M(M = Co, Ni, Mg, Zn 등)는 MOF 결정 구조에 영향을 끼치지 않고 다른 금속과 결합하여 균일한 바이메탈릭 질소화물 복합체 제조가 가능하다는 이점이 있다.54) Guo 그룹은 MOF-74를 질화하여 넓은 pH 범위에서 HER 활성이 뛰어난 다공성 막대 모양 cobalt-nickel nitride(Co x Ni y N)를 보고하였다. (Fig. 8a)55) Fig. 8b에서 볼 수 있듯이 Co x Ni y N은 약 760 nm 의 지름을 갖는 일차원 막대 구조 형태를 보유하였다. 1 M KOH 전해질에서 실시한 전기화학 실험에서, 제조한 Co x Ni y N 촉매 사이 중 Co2 Ni1 N 촉매는 약 21 mV의 개시 전압(η onset)을 나타내어 Co1 Ni1 N(η onset = 42 mV), Co1 Ni2 N(η onset = 88 mV)에 비해 나타내 가장 낮은 과전압을 기록하였다. 또한, Co2 Ni1 N 촉매는 102.6 mV의 η10 값과 24 시간 안정성을 보유하여 뛰어난 HER 활성을 나타내었다. (Fig. 8c) 0.5 M H2 SO4, 1.0 M PBS에서 실시한 전기화학 실험에서도 Co2 Ni1 N 촉매의 η10은 각각 92, 152.8 mV를 기록하며 염기, 산, 중성 전해질 조건에서 모두 뛰어난 HER 활성을 나타내었다. Co x Ni y N 촉매의 우수한 HER 활성은 MOF 전구체 적용으로 인한 조성 및 구조 제어와 균일한 원소 분포 그리고 계층적 다공성 구조에 의한 높은 비표면적, 풍부한 메조 기공 및 고분산된 촉매 활성점 때문인 것으로 제시되었다.
결론
온실가스 및 오염물질을 배출하지 않는 청정한 수소 생산법인 수전해 시스템의 상용화를 위해서는 고효율의 비귀금속 기반 촉매의 개발이 필수적이다. 전이금속 질소화물은 우수한 물리화학적 특성으로 수전해 시스템의 HER 촉매로 연구가 진행되고 있으며 그 활성을 향상시키기 위해 최근 바이메탈릭 질소화물 촉매가 폭넓게 연구되고 있다. Ni-Mo-N, Co-Mo-N, Ni-Fe-N, Ni-Co-N과 같은 바이메탈릭 질소화물은 두 전이금속의 시너지 효과로 인한 활성점 증대 및 전자 전도도 향상으로 모노메탈릭 질소화물에 비해 월등히 뛰어난 HER 활성을 기록하였으며, Ni foam, carbon cloth와 같은 전도성 기판에 성장시킬 경우 활성 및 안정성의 추가적인 향상을 달성하였다.
최근 나노 기술과 계산화학 등의 발전은 특정 물성을 제어할 수 있는 금속 조합의 예측과 그에 따른 바이메탈릭 질소화물의 제조를 가능케 하고 있다. 이러한 바이메 탈릭 질소화물은 앞서 언급한 HER 반응뿐 아니라 OER 및 산소환원반응 (Oxygen Reduction Reaction, ORR) 등 다양한 분야에 적용되어 그 중요성이 높아지고 있다. 바이메탈릭 질소화물의 실제 응용까지는 추가적인 연구가 필요하지만 효과적인 합성법 개발, 조성 및 구조 제어 등 지속적인 발전이 이루어진다면 다양한 분야에서 신규 촉매 개발의 기회가 될 수 있을 것이다.