수계 아연 이차전지 전해질 연구 개발 동향
A Review on Electrolytes for Aqueous Zinc-Ion Batteries
Article information
Abstract
Abstract
Growing attention to eco-friendly and sustainable energy sources makes people focus on the improvement of grid-scale energy storage systems. Lithium ion batteries have demerits for these applications due to the use of flammable non-aqueous electrolytes. With this regard, aqueous electrolytes have been actively investigated because of its safe property, fast charge/discharge rate capability, easy preparation process, non-toxicity, and eco-friendliness. Among many candidates for aqueous battery system, zinc ion has attracted considerable interests. Zinc has advantages of abundance, low redox potential, and high volumetric capacity. However, when used in alkaline electrolytes, several problems such as dendritic growth, formation of irreversible intermediates and capacity fade hamper its practical use. Even though mild acidic electrolytes were used to suppress dendritic growth, the corrosion of zinc anode and current collectors still depressed the cycling stability. Herein, we introduce recent studies on electrolytes for aqueous zinc ion battery revealing their principles, working mechanism and research goals.
1. 서론
화석연료 사용으로 인한 각종 환경문제가 심각해짐에 따라 친환경적/경제적이며 지속 가능한 에너지원에 관한 관심이 계속해서 커지고 있다. 이에 화석연료에 대한 의존성을 낮추고 지속 가능한 에너지원의 개발을 목
표로, 전 세계적으로 신재생 에너지 및 에너지 저장장치 관련 연구를 활발히 수행하고 있다. 가장 대표적인 에너지 저장장치로, 수십 년간 연구가 진행된 리튬 이온 이차전지(Lithium ion battery, LIB)는 높은 에너지밀도와 우수한 수명특성으로 인해 소형 전자기기부터 전기자동차, 대용량 에너지 저장장치(Energy storage system, ESS) 등에 활발히 사용되고 있다. 하지만, 누액, 팽창, 부반응, 폭발의 위험성 등의 고질적인 안전성 문제가 여전히 해결되어야 할 과제이며 리튬, 전이금속 전구체 등의 원료에 대해서는 제한된 매장량, 높은 가격, 가격 불안정에 따른 자원의 무기화 등의 문제가 존재한다.
이에 리튬 이온 기반 에너지 저장장치를 대체하려는 시도가 활발히 진행되고 있다. 먼저 소듐(Na), 포타슘(K) 이온 전지 등의 알칼리 금속 이차전지는 소재의 풍부한 매장량과 낮은 가격의 장점이 있지만 큰 이온 반지름, 전극 소재와의 낮은 가역 용량 및 좁은 반응 전압 등으로 리튬 이온 이차전지에 비해 낮은 에너지밀도를 나타낸다. 또 다른 이온으로, Mg2+, Ca2+, Zn2+, Al3+와 같은 다가 금속이온 전지(multivalent metal-ion batteries)에 대한 연구도 활발히 수행되고 있다. 다가 이온 이차전지는 다가 양이온과 반응하는 양극재를 사용했을 때 한 이온이 복수 전하와 반응에 참여한다는 장점이 있다.1) 하지만, 이때 생기는 강한 정전기적 상호작용이 고체상 확산(solid-state diffusion)을 저해하므 로 빠르고 가역적인 이온의 삽입/탈리(intercalation/ deintercalation) 과정을 방해한다.2) 게다가 전극/전해질 계면에서 용해된 다가 이온은 이온 주위를 둘러싸며 상호작용하는 용매 껍질(solvent shell)로부터 강한 정전기적 힘을 받아 탈용매과정이 방해되며, 이는 다가 이온의 전극 물질 내 삽입 과정을 방해한다. 이러한 현상을 탈용매 불이익(desolvation penalty)이라 일컫고, 다가 이온 기반 이차전지의 성능 향상을 위해서 극복해야 할 장애물로 여겨진다.3)
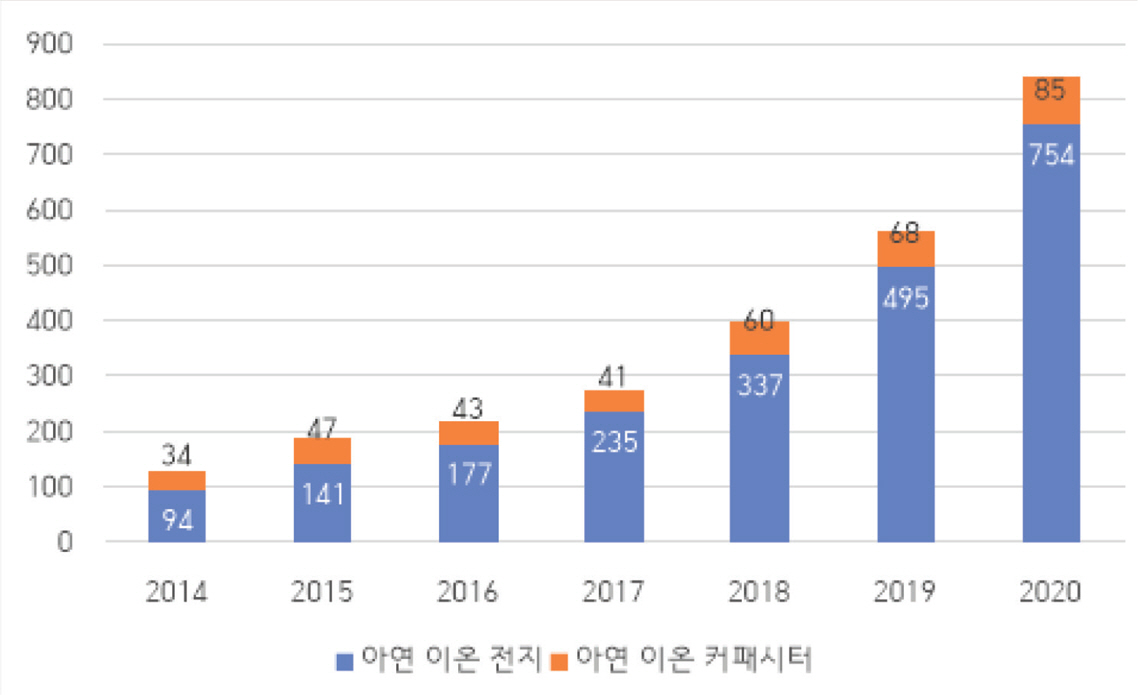
한편, 불규칙적으로 발생하는 태양, 풍력, 해양, 지열 에너지 등과 같은 신재생 에너지의 효율적인 저장을 위하여 ESS에 대한 필요성이 커지고 있다. 소형화를 중요시하는 LIB와는 다르게 ESS는 부피/무게에 대한 제약이 덜해 낮은 생산단가와 보수/유지 비용이 중요한 요소로 여겨지며, 높은 에너지밀도, 빠른 충·방전 속도, 높은 안정성을 요구한다. 이를 만족하는 차세대 에너지 저장장치로서 수계 아연 이온 이차전지(aqueous zinc ion battery, AZIB)가 주목을 받고 있다. 특히, AZIB는 그리드 시스템에 적용하기 적합한 후보 에너지 저장장치로 많은 연구가 진행되었다. 실제로, 최근 몇 년간 아연 이온을 활용한 수퍼커패시터(supercapacitor)나 이차전지에 관한 연구의 수가 급격하게 증가하고 있다. (그림 1)
가연성이 있어 충·방전 과정에서 발생한 산소 기체와 더불어 화재의 위험성을 초래하는 유기용매 전해질과 비교했을 때,4) AZIB는 다음과 같은 장점들이 있다. 먼저, 물을 전해질 용매로 사용하기 때문에 전지의 장기간 사이클 이후, 단락(short circuit) 문제가 발생하더라도 발화 위험이 없어 안전한 구동이 보장된다. 게다가, 수계 전해질은 독성이 없고 유기용매에 비해 빠른 이온 전도 특성을 보이기도 한다. 또한, 아연 금속은 다전자 교환과, 높은 밀도(25℃에서 7.13 g cm−3)를 가져, 리튬 금속 음극의 3배에 이르는 높은 부피당 용량(5851 mAh cm−3)을 가지며 낮은 산화 환원 전위[-0.76 V vs 표준 수소 전극(standard hydrogen electrode, SHE)]로 인해 넓은 작동 전압 및 높은 에너지밀도 달성이 가능하다는 큰 장점도 지닌다.5,6) 이외에도, 아연은 지구상에 풍부한 물질로 친환경적이고 원가가 저렴하다는 장점이 있는데, 아연 금속의 매장량은 리튬 금속의 매장량보다 3000배 많은 것으로 알려져 있다.7)
전기화학적 에너지 저장장치는 양극, 음극, 전해질, 분리막으로 구성되어 있으며, 이중 전해질은 아연 이온을 양 전극으로 운송하는 역할을 한다. 또한, 전기화학적으로 안정한 반응 전압 영역을 결정하면서 쿨롱 효율(Coulombic efficiency)에 영향을 미쳐 결국 전지의 성능에 직접 영향을 준다. 최근 아연 금속 음극의 안정화,8–10) 아연과 반응하는 고용량 양극 소재 개발 연구와11–13) 더불어, 수계 액체 전해질, 이온성 액체(ionic liquid) 전해질, 유기 전해질, 겔 전해질 등 수많은 전해질에 관한 연구가 진행되고 있다.14–17) 먼저, 연구 초기에는 KOH 기반의 알칼리계 전해질이 주로 사용되었으나,18) 낮은 쿨롱 효율과 아연 수지상(dendrite) 형성에 따른 안정성 문제, 아연 산화물 부산물 생성, 빠른 용량 저하 문제가 발생하여 실용성이 떨어졌다. 중성 또는 약산성의 수계 전해질의 경우, 알칼리계 전해질과는 다르게 AZIB에 수지상 형성으로부터 방해받지 않는 등, 더 적합함을 보였으나 쿨롱 효율과 반응 전압 영역대가 더 개선되어야 할 필요가 있다. 가장 보편적으로 사용되는 전해질인 ZnSO4 수용액과 Zn(CF3 SO3)2 수용액은 낮은 쿨롱 효율을 가지며, 전기화학 반응 중 양극 물질이 전해질에 용해되고 비가역적인 부반응까지 수반해 용량 손실의 문제점을 가진다.7,19,20)
앞서 언급한 바와 같이 전해질은 AZIB의 성능에 직접 적인 영향을 주기 때문에 다양한 형태의 전해질 연구가 활발히 진행되고 있다. 따라서, 본 총설 논문에서는 아연 이온 기반의 전기화학적 에너지 저장장치와 관련하여 연구된 최근 논문 중, 전해질에 관한 연구를 집중적으로 소개하고, 주제별로 나눠 다루고자 한다. AZIB에 적용을 위한 1) 다양한 전해질의 소개와 2) 수계기반 전해질에서의 물 분해를 억제해 작동 전압 영역(working voltage range)을 넓힌 연구, 3) 겔 전해질의 도입, 4) 첨가제의 활용 전략, 나아가 전반적인 연구 동향 및 방향성에 대해서 언급하고자 한다.
2. 수계 액체 전해질(Aqueous liquid electrolyte)
수계 액체 전해질은 물을 용매로 사용하는 전해질을 일컫는다. 연구 초기에는 KOH를 염으로 사용한 알칼리계 전해질을 주로 사용했다. 이후에 중성 또는 약산성의 ZnSO4 수용액과 같이 아연 이온(Zn2+)을 전하 운반체로 사용하는 아연 염 전해질은 재 충·방전이 가능하고, 오랜 충·방전이 가능하며, 가격이 낮은 장점이 있다. 또한, 수계 전해질의 전극/전해질 계면에서의 전하 운송 저항(Charge transfer resistance, R CT)이 비수계의 값보다 현저하게 낮아, 빠른 출력특성을 나타낸다. 예를 들어 Nazar 연구 그룹의 연구결과에 따르면,3) 아연 금속을 상대 전극으로, 층상 구조의 V3 O7· H2 O 물질을 작업 전극으로 구성한 전기화학 전지에서 R CT 값을 비교한 결과, 비수계 전해질에서 저항이 15–100배 크게 나타났다. 그러나 수계 기반 전해질의 경우 물 분해 반응(1.23 eV)으로 인해 비수계(유기계) 전해질을 사용하는 유기계 아연 이차전지(2–3 V)와 비교하여 작동 전압이 낮아 결과적으로 이차전지의 에너지밀도가 낮아지는 문제가 있다. 게다가, 중성이거나 약산성의 수계 전해질은 아연 이온 수지상 형성을 억제하고 망간 기반 양극재에 안정적인 구동을 가능하게 해 AZIB에 적합하다고 알려졌으나 여전히 아연 음극이나 집전체가 산성 전해질로부터 부식하게 되면서 사이클 안정성을 악화시킨다.21)
이번 장에서는 먼저 AZIB관련 연구에 주로 사용되는 전해질 염의 종류와 농도에 따른 특성, 약산성 전해질 조건에서의 수지상 형성 등을 소개하고, AZIB의 성능 향상을 위한 전해질 염의 고농도화 전략 연구 중 흥미로운 결과를 소개하고자 한다.
Onset potential and Coulombic efficiency (CE) values from CV analysis (Figure 2) for Zn(CF3SO3)2 and ZnSO4 electrolytes. Reproduced from Zhang et al. J. Am. Chem. Soc. 2016;138:12894–12901, with permission of American Chemical Society [14].
2.1 전해질 염의 종류
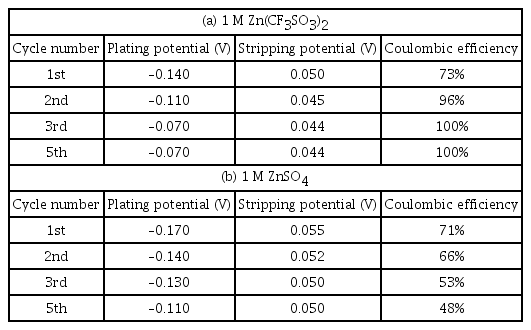
AZIB는 주로 아연 금속을 음극으로 사용하고, 양극재로는 망간, 바나듐 기반 물질을 사용하여 연구되고 있다. 전해질로는 ZnSO4 또는 Zn(CF3 SO3)2, Zn(NO3)2, Zn(ClO4)2, ZnCl2, Zn(CH3 COO)2, Zn(BF4)2· xH2 O, Zn(N(CF3 SO2)2)2 (Zn(TFSI)2)와 같은 염들이 주로 사용되었다.6,22–26) 이 중에서도 ZnSO4, Zn(CF3 SO3)2는 부식성이 강한 Cl−나 NO3−를 포함하지 않아 충·방전 중 아연 음극을 안정화한다. Chen 연구 그룹은 양이온 결핍성 스피넬 구조 ZnMn2 O4를 양극으로 활용한 전지에서, ZnCl2, ZnNO3, ZnSO4, Zn(CF3 SO3)2을 아연 염으로 사용해 각 전해질의 농도에 따른 결과를 비교했다. 그중 1 M의 ZnSO4와 1 M의 Zn(CF3 SO3)2 전해질이 각 각 전기화학 반응 중 물 분해로 인한 산소 발생 반응을 억제하면서 구동 전압 영역대를 2.3 V 이상으로 넓힌다는 것을 보였다.14) (그림 2a, b) 또한, 아연이온의 더 가역적인 증착/용해 반응을 이끌었으며, Zn(CF3 SO3)2의 농도가 올라감에 따라 이온 전도도는 감소하고 점도는 증가했는데(그림 2c), 이는 고농도에서의 높은 점도가 용매화 및 전하 운송 경향을 바꾸면서 안정성을 강화하기 때문이다. 또한, 고농도의 염은 물의 활성도와 물로부터의 부반응을 낮춰 높은 사이클 안정성을 가져다준다. 한편, Zn(CF3 SO3)2는 ZnSO4와 비교했을 때 쿨롱 효율이 점차 증가해 3번째 사이클 이후에는 100%에 이르지만 ZnSO4의 경우에는 각 사이클마다 쿨롱 효율이 낮았고 사이클이 지날수록 감소하는 경향을 보였다. (표 1) 이는 CF3 SO3− 음이온이 부피가 커서(bulky) 아연 양이온을 감싸는 물 분자의 수를 줄여 용매화 효과를 낮춰주므로 아연 양이온의 운송을 촉진했다고 설명한다.
이와 비슷하게, Shuquan Liang 그룹은 ZnSO4, ZnCl2, Zn(CH3 COO)2, Zn(NO3)2의 네 가지 전해질을 사용하고, ZnSO4 전해질의 여러 농도 조건에서 V2 O5 양극을 사용해 전기화학적 성능을 평가했다.6) 네 가지 염을 각각 3 M의 농도로 제조해 테스트한 결과로, ZnSO4가 가장 높은 가역 용량과 오랜 기간의 사이클을 보였다. 이는 나머지 세 염의 음이온(CH3 COO−, NO3−, Cl−)의 부식성과 같은 불안정성에 기인한다. ZnSO4의 농도 구배에 따른 결과를 알아보기 위해 0.5 M, 1 M, 1.5 M, 2 M, 2.5 M, 3 M의 ZnSO4 전해질이 평가되었는데, 3 M의 ZnSO4 전해질이 0.5 A g−1에서 100 사이클 이후에 128 mAh g−1의 가역 용량을 보이며 가장 뛰어난 성능을 보였다. 게다가, 초기 쿨롱 효율은 67%이었지만 수 사이클 이후의 쿨롱 효율은 ∼98%까지 상승하였다.
이 외에도 Zn(TFSI)2를 전해질 염으로 활용한 연구결과가 있다. Liqiang Mai 연구진은 층상 구조의 Fe5 V15 O39(OH9)·9H2 O 양극재의 성능을 평가하기 위해 전해질로 Zn(TFSI)2를 사용하였는데, ZnSO4와 비교했을 때 장기간의 사이클에서도 용량을 더 잘 유지하는 경향을 보였다.27) 이는 앞의 Zn(CF3 SO3)2 전해질의 경우와 유사하게 Zn(TFSI)2 전해질 속에 부피가 큰 TFSI− 음이온이 아연 이온(Zn2+)을 감싸는 물 분자의 수를 줄여 용매화 효과를 감소시킴으로써 아연 양이온의 운송이 빨라져 더 안정적인 전기화학적 성능을 보여준다고 설명된다.
2.2 금속 수지상 형성
KOH 기반 알칼리계 전해질에서의 아연 금속 전지는 음극에서 생기는 수지상 형성이라는 고질적인 문제점을 가져서 수명특성에 치명적인 단점을 가지고 있다. 수지상 형성은 계속해서 자라나게 되면 일부가 음극에서 떨어져 나와 전해질과 부반응 함으로써 더는 활물질로 사용되지 못할 뿐만 아니라, 양극에 맞닿으면 전지의 단락(short circuit)을 일으키기도 한다. 또한, KOH 기반 알칼리계 전해질에서의 아연 수지상은 아연산염이 불활성 ZnO 층으로 분해되어 균일한 이온 확산과 증착을 방해하면서 문제를 일으킨다.31) 반면에 중성 또는 약산성의 조건에서는 아연 수지상이 뾰족하게 자라나는 리튬 수지상이나 알루미늄 수지상과는 다르게 아연 이온 확산의 운동학적 요소(kinetic factor)에 의해 2D 구조의 육각 평판 모형으로 성장하는 경향이 있어 보다 안정적이다. (그림 3) 이처럼 중성이거나 약산성인 전해질에서의 수지상 형성은 알칼리계 전해질에서 보다는 완화된 결과를 보이지만, 음극 표면에서의 수소 발생 반응으로 인한 pH 변화는 불활성의 아연산염(Zn(OH)42-)의 형성을 촉진하면서 결국 수명 성능에 영향을 미치고, 이는 아연 수지상 문제를 악화시킬 수 있다.30,32) 게다가, 높은 전류밀도에서는 과전압이 증가해 수지상 형성을 촉진할 수 있으므로 해결되어야 할 문제로 남아 있다.

contrast of topologies between Zn dendrite and its counterparts (Li, Al). (a) SEM image of Li dendrite. Reproduced from Zheng et al. ACS Energy Lett. 2016;1:1247–1255, with permission of American Chemical Society [28]. (b) SEM observation of Al dendrite. Reproduced from Chen et al. ACS Appl. Mater. Interfaces 2017;9:22628–22634, with permission of American Chemical Society [29]. (c) SEM image of Zn dendrite. Reproduced from Yang et al. Adv. Mater. 2020;32:2001854, with permission of John Wiley and Sons [30].
수지상 형성을 억제하는 전해질 개질 전략으로 첨가제의 활용을 통한 전기장 유도식 아연 증착, 타 금속-아 연 합금(alloy) 형성을 통한 영역 선택적 결정핵 생성 유도, 겔 전해질 활용을 통한 물리적 억제 등과 같은 방법들이 있는데 이러한 전략들은 장 3에서 자세하게 소개하고자 한다.
2.3 고농도 전해질
수계 전해질의 빠른 충·방전 특성과 뛰어난 안정성 등의 장점에도 불구하고, 물 분해 반응의 위험성으로 인한 좁은 범위의 작동 전압(<2 V)은 전극의 산화 환원 반응이 이 영역대 안에서 일어나야 하므로 전극 활물질의 선택폭을 줄이고, 전지의 에너지밀도를 제한시킨다.11,33) 작동 전압 영역대를 넓히는 방법으로, 전해질 내 염의 농도를 대폭 증가시킨 접근 방식이 보고되었다. Chunsheng Wang과 연구진은 수계 리튬 이온 전지에서 21 M의 LiTFSI 전해질을 사용해 수계 전해질에서의 고농도화 전략을 처음으로 제시했다.34) 물이 먼저 환원되어 수소가 발생하는 보통의 전해질과는 달리, 고농도의 전해질에서는 TFSI− 음이온이 최초용해껍질(primary solvation sheath)에 존재하고 TFSI−가 우선적이고 지배적으로 환원이 되는 반응을 보이면서 물의 환원을 늦춰 더 낮은 전위에서 물이 환원되게 함으로써 넓어진 작동 전압 영역대를 가능하게 한다.
Chunsheng Wang 그룹은 이러한 원리를 적용해 수계 아연 이온 전지에도 고농도화 전략을 사용한 연구를 진행했다.35) 1 M의 Zn(TFSI)2와 20 M의 LiTFSI를 혼합한 고농도의 전해질은 거의 100%의 쿨롱 효율을 달성하는 가역적인 구동을 보였다. 비교군으로 1 M의 Zn(TFSI)2 와 5 M의 LiTFSI 전해질을 혼합한 전해질에서는 6개의 물 분자가 Zn2+ 이온을 둘러싸면서 TFSI−의 영향이 적었다. 중간 비교군인 1 M의 Zn(TFSI)2 와 10 M의 LiTFSI 전해질에서는 Zn2+ 이온의 최초용해껍질을 채우기 시작했고, 고농도인 1 M의 Zn(TFSI)2와 20 M 의 LiTFSI 전해질에서는 Zn2+ 이온 주위를 TFSI−가 둘러싸 (Zn-(H2 O)6)2+가 아닌 (Zn-TFSI)+의 이온쌍을 형성하면서 TFSI− 이온이 물의 환원을 저해해 수소 발생을 막고 안정적인 아연 도금/박리 반응을 유도했다. 또 다른 전해질의 고농도화 연구로, Jia-Xing Jiang과 연 구진은 30 M의 ZnCl2 전해질을 사용했다.36) 가격이 높은 불소화 염 기반 전해질들과 비교했을 때 ZnCl2 염은 상대적으로 저렴하다. 일반적으로 묽은 ZnCl2 수용액은 (Zn(OH2)6)2+나 (Zn(OH2)2 Cl4)2-와 같은 이온화 종들을 포함하지만, 30 M의 ZnCl2 전해질에서는 모든 아연이온이 팔면체 배위를 형성하는 데 필요한 ZnCl2·1.8H2 O 가 생성될 수 없다. 결과적으로 자유로운 물분자가 거의 없게 되고 (Zn(OH2)6)2+나 (Zn(OH2)2 Cl4)2-가 줄어든다. 한편, ZnCl2의 농도가 증가함에 따라 (ZnCl4)2-가 생겨나고 이는 전기화학적으로 비활성인 Zn(OH)2나 ZnO 같은 부산물의 생성을 억제한다고 설명한다. 작동 전압 영역은 5 M의 ZnCl2 전해질에서 1.6 V를 나타내던 결과가 30 M의 ZnCl2 전해질에서는 2.3 V값으로 증가함을 보였다. 30 M의 ZnCl2를 바나듐 산화물 양극|아연 금속 음극 전지에 적용한 연구결과도 존재한다. Shumin Han과 연구진은 아연 금속을 음극으로 사용하고 Ca0.20 V2 O5·0.80H2 O를 양극으로 사용하여 1 M의 ZnCl2와 30 M의 ZnCl2 전해질을 사용하여 전기화학 성능을 비교했다.37) 고농도 전해질을 사용했을 때, 용량은 296 mAh g−1에서 496 mAh g−1으로 증가하면서 작동 전압 영역대도 0.4 V까지 넓어졌고, 50 mA g−1 (C/10)의 낮은 전류밀도에서 100 사이클 이후의 용량 유지가 8.4%에서 51.1%로 증가했다.
전해질의 고농도화 전략은 작동 전압 영역대를 높이고 높은 가역성을 보장해주는 참신한 전략으로 여겨졌지만 고농도화를 위해 필요한 많은 양의 고가의 전해질(특히, Zn(CF3 SO3)2, LiTFSI)이 공정단계에서의 단가를 높이고 이 때문에 실제로 적용되기는 어려운 측면이 있다. 이를 해결하기 위해서는 값싼 전해질 염의 발견 및 높은 농도가 아니어도 탈용매 효과를 보장할 수 있는 첨가제의 사용 등의 전략이 필요하다.
3. 겔(gel) 전해질
이차전지에서 겔 전해질은 강한 물리적 특성 때문에 금속 음극 표면에서의 수지상 형성을 억제하고, 활물질이 용해되는 문제를 해결하기 위해 액체 전해질을 대체 하여 사용된다. 또한, 기존 액체 전해질이 가지는 누수 문제가 없고, 전해질의 역할과 더불어 분리막의 역할을 동시에 수행함으로써 제조 공정이 간편화된다. 또한, 겔 전해질의 경우 구부러지는 특성으로 전지의 유연성을 더할 수 있다. 이러한 유연한 기계적 특성은 플렉서블, 웨어러블 기기 등의 에너지 저장 분야에 적용할 가능성을 갖는다.38–40)
연구 초기의 아연 기반 전지에서는 아연 이온을 전도하는 겔 전해질이 많이 발견되지 않아 LIB보다 연구가 활발하게 진행되지 않았다. 일반적으로 poly(ethylene oxide)(PEO)-ZnX2(X=Cl, Br, I, ClO4, CF3 SO3) 또는 poly(vinilydene fluoride)(PVDF)/PEO-Zn(CF3 SO3)2와 같은 물질 조합을 사용한 연구가 보고되었지만, 이온 전도도가 낮고(10−5-10−6 S cm−1), 고분자의 분해가 빠르며, 기계적 강도가 낮아 충·방전이 가능한 아연 전지 구동에는 적합하지 않다.41,42) 시간이 지나고 아연 이온 전지에 관한 관심이 커지면서, 아연 금속 이차전지에도 겔 전해질을 아연 이온 전지에 적용한 연구가 증가했는데, 주로 비수계 또는 수계 액체 전해질에서 팽창된 PEO, 잔탄검(Xanthan gum), 젤라틴(Gelatin), polyacrylamide(PAM), PVDF 등과 같은 이온 전도성 고분자들이 연구되면서 비교적 높은 이온 전도도(10−4-10−3 S cm−1)를 보였다.43) 또한, 다양한 음극 및 양극재를 자가치유(self-healing)특성을 가진 고분자, 유연성 고분자 등의 겔 전해질과 결합해 활용성을 높이고, 겔 전해질의 열, 기계적 안정성 등을 확보하는 연구들이 보고되었다. 이어지는 단락에서는 겔 전해질을 활용한 사례를 소개하고자 한다.
3.1 PEO 기반 고체 전해질
PEO는 H-(O-CH2-CH2) n-OH의 구조를 가지는 고분자 화합물로서, 유연한 결합 사슬을 가지고 에테르(ether)기의 산소가 양이온과 상호작용함으로써 다양한 종류의 염들을 용해시킬 수 있다는 장점을 가져 리튬 이온 전지의 고체 전해질로서 많이 사용되지만, 이온 전도도가 높지 않다는 단점이 있다.44) 아연 이온도 PEO를 통해 전도되어 전지에 적용될 수 있는데, 그 예로, Vickers 연구진이 PEO8· ZnBr2 전해질 기반 Zn-MnO2 전지를 제조해 안정성을 높였고, Amaratunga 연구진은 PEO 전해질에 TiO2 세라믹 첨가제를 첨가해 이온 전도도와 기계적 안정성을 향상한 연구가 있다.45,46) Zn-MnO2/ CNT 시스템에 TiO2가 첨가된 PEO 전해질에서, PEO의 결정상 형성이 억제되면서 이온 전도도를 높였다.
세라믹 첨가제 이외에, 아연 염을 PEO 전해질과 혼용 하여 사용하는 전략도 보고되었다. Agrawal 연구진은 PEO와 Zn(CF3 SO3)2 염을 여러 질량비로 제조하고 아연|아연 대칭 셀에서 테스트했을 때, 그 중 최적값인 9:1의 질량비로 혼합하여 만든 고체 전해질이 가장 높은 이온 전도도(1.09×10−6 S cm−1)를 보였다.47) 이 값은 순수한 PEO의 이온 전도 값(3.2×10−9 S cm−1)을 웃도는 높은 수치다. PEO 기반의 전해질에서 아연 염은 중요한 역할을 하게 된다. 아연 염이 용해되었을 때 자유 이온들이 PEO 매트릭스에 존재하게 되는데, 큰 음이온이 PEO 매트릭스에 해리된 염 매질에 적용되면 아연 자유이온은 높은 이온 전도도와 안정성을 보여준다.
3.2 잔탄검 기반 겔 전해질
잔탄검은 식물 병원성 박테리아인 Xanthomonas campestris pv. campestris로부터 생산되는 천연 고분자로서 자연에 풍부하게 존재하는 다당류이다.48) 잔탄검 의 곁사슬(side chain)에 붙어 있는 수산화기(hydroxyl group)로 인해 물 분자를 잘 끌어오고 긴 탄소 사슬은 물과 잔탄검 사이의 상호작용을 강화한다. 분자 구조상으로 잔탄검은 높은 이온 전도도, 높은 용해도, 높은 점도의 특성을 가져 겔 고분자 전해질로서 잠재력을 가진다고 알려져 있다.49,50)
Qingwen Li 그룹은 MnO2/탄소 나노튜브를 양극으로 활용한 Zn-MnO2 전지를 잔탄검, 2 M ZnSO4, 0.1 M MnSO4를 혼합한 겔 전해질로 제조했다.51) (그림 5) 이 연구에서는 잔탄검 전해질이 낮은 온도에서의 뛰어난 안정성을 보였다. 초기의 이온 전도도는 1.65×10−2 S cm−1로 측정되었고, −8 ℃에서의 이온 전도도는 2.5×10−3 S cm−1로 유지되었다. 심지어 5 ℃에서 1년간 저장한 이후의 이온 전도도는 초깃값과 유사하게 유지되었다. 잔탄검 전해질을 사용해 제조한 전지는 1 C(0.15 mA cm−2)에서 260 mAh g−1의 높은 방전용량을 가졌 고, 10 C의 높은 충·방전 속도에서는 176 mAh g−1의 방전용량을 보였다. 사이클 성능을 측정했을 때는 1 C의 정전류에서 330 사이클 이상 구동시켰을 때 282 mAh g−1(약 90%의 용량 유지)를 보였고 5 C의 정전류에서 구동시켰을 때는 150 사이클 이후에 용량 감소가 나타났으나 이후에 1000 사이클까지 127 mAh g−1 정도로 안정화되는 양상을 나타냈다.
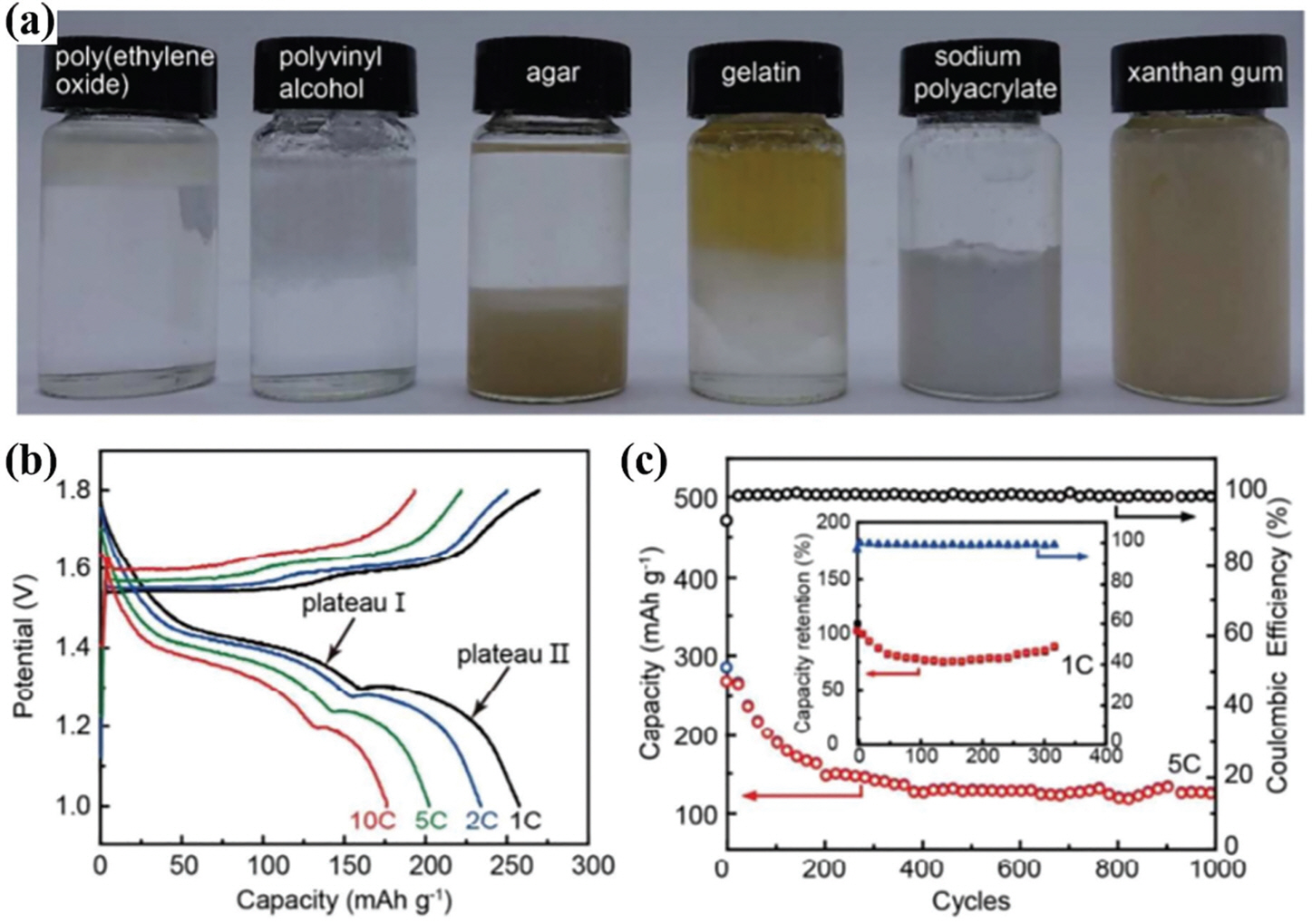
(a) Photograph of aqueous solutions of 2 M ZnSO4 and 0.1 M MnSO4 after adding 10 wt% polymers of PEO, polyvinyl alcohol(PVA), agar, gelatin, sodium polyacrylate and xanthan gum showing that PEO, PVA, agar, gelatin and sodium polyacrylate were aggregated while xanthan gum was uniformly dissolved in the solution. (b) Galvanostatic charge/ discharge profiles at different rates from 1 C to 10 C. (c) Specific capacity and coulombic efficiency as a function of charge/discharge cycles at rates of 1 C(inset) and 5 C, respectively. Reproduced from Zhang et al. J. Mater. Chem. A 2018;6:12337–12243, with permission of Royal Society of Chemistry [51].
또 다른 잔탄검 활용 사례로, Ying Wang과 연구진은 나노 벨트 형태의 NH4 V3 O8·1.9H2 O를 양극으로 사용하고, 12 M의 고농도 아연 염을 전해질로 사용했는데, 이때 잔탄검을 추가로 사용하여 겔 형태로 전환했다.52) 이 연구는 영하의 온도에서도 비교적 높은 가역 용량을 가지고 사이클 특성 향상을 위해 고농도화 전략과 잔탄검 전해질을 활용했다. 아연 염으로는 다양한 온도에서 물에 용해가 잘 된다는 점을 활용해 ZnCl2를 활용했다. 높은 염 농도로 인해 전해질의 어는점이 낮아져 저온 구동이 가능하고 사이클 과정에서 활물질이 전해질로 손실되는 것을 막아 사이클 특성을 향상한다. 하지만 고농도의 ZnCl2 수용액은 강한 산성이어서 전극에 부식과 같은 문제를 일으킬 수 있는데 이를 해결하기 위해 음이온성 생고분자 구조를 가져 내염성(salt-tolerance)이 좋은 잔탄검을 활용해 전해질을 겔 형태로 전환하는 방법을 이용했다. 20 ℃과 −20 ℃에서 이온 전도 값을 측정해 본 결과 20 ℃에서는 13.8 mS cm−1로 다른 전해질(젤라틴, PEO, poly(ε-carpolactone), polyvinylpyridine 등)보다 높은 값을 나타냈고, −20 ℃에서는 5 mS cm−1로 측정되었다.53–56) 제조된 전지는 가역 용량과 충·방전 속도에 대한 성능 테스트도 진행되었고, 0.2 A g−1의 전류밀도로 충전되었을 때 20 ℃에서 283 mAh g−1, 0 ℃에서 215 mAh g−1, −20 ℃에서 119 mAh g−1의 방전용량을 보였다. 또한, 1.5 A g−1의 전류밀도로 800 사이클 이후에도 20 ℃에서 90.3%, 0 ℃에서 90.7%의 용량을 유지했다. −20 ℃에서는 0.5 A g−1로 구동되었을 때 450 사이클 이후에도 초기 용량의 83%를 유지하는 높은 사이클 성능을 보였다. ESS의 저온에서의 안정성 확보를 위한 측면, 유연한 특성을 활용한 웨어러블 기기에 적용할 수 있다는 측면에 있어서 의 미 있는 결과라고 할 수 있다.
잔탄검은 내염성이 높아서 이온 전도도가 높지만, 기계적 강도가 낮은 한계가 있다. 또, 겔 전해질의 늘어나는 특성으로 인해 인장력이 가해졌을 때 전극과 집전체 사이의 접합이 떨어져 용량 감소를 초래하기도 한다.57) 이러한 문제점을 해결하기 위해서는 탄소 물질이나 고분자 물질을 집전체에 코팅해 전극과 집전체 계면 사이 접착력을 향상하는 방법 등이 고안되어야 할 필요가 있다
3.3 젤라틴 기반 겔 전해질
젤라틴은 변성 콜라겐으로부터 추출되어 주로 프롤린, 하이드록시프롤린, 글리신으로 구성된 천연 고분자 중 하나로서 분자 가지에 많은 친수성 작용기가 달려있다. 따라서, 고분자 매트릭스에서 물 분자를 잘 함유해 높은 이온 전도도를 가진다.58) 일반적으로, 젤라틴은 가열 조건에서 수계 전해질에 쉽게 용해되고, 이후에 냉각 과정에서 나선형 구조로 변하면서 고체 네트워크를 형성하는데 이 고체 네트워크는 전극에 코팅되어 높은 유연성을 가질 수 있다.59)
젤라틴을 전해질로 활용한 연구로, Yu Liu 그룹은 0.5 M의 Li2 SO4와 0.5 M의 ZnSO4를 젤라틴 전해질과 혼합해 연구를 수행했다.60) 이렇게 제조된 전해질은 6.15×10−3 S cm−1의 높은 이온 전도 값을 보였고, 5 ℃에서의 전해질의 압축 강도는 25 ℃에서의 압축 강도보다 2배 높은 값을 나타냈다. 사이클 안정성을 확인하기 위해 아연|아연 대칭 전지에서 젤라틴 기반 전해질을 사용했을 때는 자가부식 현상과 수지상 형성을 거의 보이지 않았다. 또, 젤라틴의 친수성으로 인해 물을 잘 함유해 물의 증발도 억제할 수 있었다. 25 mA g−1의 전류밀도에서 100 사이클 이후의 용량 유지는 90%에 이르렀다. 또 다른 연구로, Kevin Huang 연구진은 젤라틴의 약한 기계적 강도의 단점을 보완하기 위해, 젤라틴과 알긴산 나트륨이 이중 가교 결합한 3D 구조의 하이드로겔 전해질을 개발했다.61) (그림 6) 하이드로겔 전해질을 제조하기 위해서는 먼저 젤라틴을 glutaraldehyde와 먼저 가교결합 하는데 이때 젤라틴 의 아민기와 glutaraldehyde가 강한 상호작용으로 공유결합하여 기계적 강도를 높인다. 다음으로 알긴산 나트륨과 CaCl2 사이의 이온 가교결합을 통해 형성된 알긴산 나트륨의 블록이 강한 미세구조를 형성해서 전해질 흡수 이후에 아연 이온 운송을 위한 발판을 제공한다. 이후에, ZnSO4 용액을 적시면 유연성 전해질로 변하게 된다. 이러한 과정을 통해 아연 이온 수송을 가속하고 기계적 특성을 향상할 수 있다. 이 전해질을 아연 금속 음극, V2 O5/CNT 나노 복합체 양극으로 적용한 완전지를 제조해서 가역 용량을 확인해 본 결과, 2 A g−1으로 구동했을 때 200 사이클 이후에 212 mAh g−1를 나타내며 초기 용량의 85%를 유지하였고 400 사이클 이후에는 79%를 유지하였다.

(a) Schematic of the overall process to make gelatin- and alginate-based membrane electrolyte (GAME) (b) Cross-linked polymers of gelatin (GE) cross-link with glutaraldehyde and Ca-alginate (sodium alginate (SA) cross-link with CaCl2). Reproduced from Lu et al. ACS Appl. Energy Mater. 2019;2:6904–6910, with permission of American Chemical Society [61].
젤라틴 기반 전해질은 젤라틴의 친수성으로 인해 이온 수송이 원활해 높은 이온 전도도의 장점이 있지만 낮은 기계적 강도로 인해 단독으로 사용되기 어렵다. 따라서 가교결합, 강도가 높은 고분자와의 블렌딩, 또는 실리카, 알루미나와 같은 무기물질과의 복합화를 통해 기 계적 강도를 높이는 방법이 고안되어야 한다.
3.4 PAM 기반 겔 전해질
PAM은 분자 구조상 많은 친수성 작용기와 아마이드 작용기(−CONH2)로 인해 물 분자를 잘 수용하고 이온 수송을 위한 네트워크 구조를 가지기에 유리해 다양한 이온의 전도성 전해질로 사용되었다.62–64) 하지만, 순수한 PAM으로만은 강한 기계적 특성을 구현하기가 어려워 화학적 가교결합과 같은 방법으로 기계적 특 성을 강화할 필요가 있다. PAM은 acrylamide 단량체(monomer)와 개시체(initiator), 가교제(cross-linker)를 활용해 가교할 수 있는데, PAM의 고분자 사슬의 작용기들과 가교제의 강한 공유결합을 통해 형성된다.
Chunyi Zhi와 연구진은 PAM과 젤라틴 기반 층상 고분자 전해질을 α-MnO2 나노 로드/탄소나노튜브를 양극으로 활용한 전지에 사용했다.65) (그림 7) 이 연구에서는 PAM을 polyacrylonitrile(PAN) 섬유막 내에 채워진 젤라틴 사슬에 접합시켜 기계적 강도와 이온 전도도를 강화했다. 3D 구조의 기공성 구조와 물 함유 능력 덕분에 굉장히 높은 상온 이온 전도도(1.76×10−2 S cm−1)를 보여줬다. 이 전해질로 제조된 완전지는 2772 mA g−1의 전류밀도에서 6.18 mWh cm−2의 높은 면적당 에너지밀도와 148.2 mW cm−2의 파워밀도를 나타냈고 61.6 mA g−1에서 306 mAh g−1의 좋은 질량 당 용량을 보여줬다. 사이클 성능 또한 2772 mA g−1의 전류밀도에서 1000 사이클 이후에도 용량의 97%를 보존해 높은 성능을 보였다. 또한, 뛰어난 안정성과 함께 유연성을 가져 웨어러블 장비에 적용할 수 있고, 절단, 구부러짐, 충격, 화염, 세척 등의 외부의 극한 조건에서도 구동하는 전지를 선보였다. (그림 7b-i)

(a) Schematic of the synthesis route to the hydrogel polymer electrolyte (HPE). Electrochemical performance of the solid-state rechargeable ZIB in different destructive tests. (b) Bending test. (c) Hammering test. (d) Combustion test. (e) Soaking test. (f) Washing test. (g) Weight loading test. (h) Drilling test. (i) Sewing test. Reproduced from Li et al. Energy Environ. Sci. 2018;11:941–951, with permission of Royal Society of Chemistry [65].
PAM 겔 전해질을 활용한 다른 연구로, Rui Li 그룹은 3 M의 Zn(CF3 SO3)2을 함유하는 PAM 전해질을 고안했다.66) 3 M의 염이 녹아있는 고분자 전해질을 활용함으로써, 고농도화 전략의 효과와 더불어 겔 전해질의 장점까지 더했다. 이 전해질을 3 M의 Zn(CF3 SO3)2 수용액 전해질과 1 M의 ZnSO4 전해질에 각각 비교하면서 수지상 형성 억제, 낮은 과전압, 아연 금속의 부식문제 해결 등의 장점을 내세웠다. 이 연구에서 사용된 양극재는 층상구조의 Mg0.1 V2 O5· H2 O 나노 벨트로, 5.0 A g−1의 전류밀도에서 358 mAh g−1의 높은 용량과 충·방전 속도를 자랑한다. PAM 기반 고농도 겔 전해질 덕분에 같은 전류밀도에서 3000 사이클 이후에 95%의 용량을 유지하는 장기간 사이클 특성을 보여줬다. 그뿐만 아니라, −30 ℃에서 274 mAh g−1, 80 ℃에서 501 mAh g−1을 보이면서 100사이클 이후에도 거의 100% 용량 유지가 되는 극한 온도 조건에서의 구동 능력도 보였다. 각 온도에서의 이온 전도도를 측정하였는데, 이는 20 ℃에서 27.1 mS cm−1, 80 ℃에서 73.8 mS cm−1, −30 ℃에서 1.9 mS cm−1로 나타나며 극한 온도 조건에서도 양호한 이온 전도도를보였다.
위의 두 연구 외에도 PAM 전해질은 가교 결합한 PAM 겔 전해질을 기능성 실(yarn) 전지에 적용한 연구,67) 녹말과 PAM을 조합해 높은 아연 이온 전도도를 얻어 아연/MoS2 나노시트 전지에 적용한 연구,68) 바인더가 없는 층상 VS2 전극을 통해 상용화 단계의 전극 로 딩양을 갖춘 연구69) 등에 다양하게 활용되었다. 대부분의 연구에서 높은 이온 전도를 보이면서 안정성, 유연성, 장수명 특성 등의 장점을 보였다. PAM을 가교결합 시켜 기계적 강도를 보완해 활용했듯이 다른 고분자 또한 가교결합을 통해 안정성을 높이는 방향으로 활용가치가 높아질 수 있다.
3.5 PVDF 기반 겔 전해질
PVDF 기반 전해질은 CF2기의 전자를 강하게 당기는 성질과 높은 유전상수(ε=8.4)로 인해 금속염의 이온화를 돕고, 이온 전도도를 향상해 음극의 안정성을 높이는 역할을 한다.70) 하지만, PEO 기반 겔 전해질과 유사하게 기계적 강도가 낮은 한계가 있다. Sampath 그룹은 PVDF와 propylene carbonate(PC), ethylene carbonate(EC), zinc trifluoromethane sulfonate(ZnTr)를 혼합하여 겔 전해질을 만들어 아연|γ-MnO2 전지를 제조하였다. 27℃에서 질량 비를 1:2:2:0.6 (PVDF/PC/EC/ZnTr)로 했을 때 가장 높은 3.94×10−3 S cm−1의 이온 전도 값을 나타냈다. 이온 전도도를 더 향상하기 위해 올리고머 poly(ethylene glycol) dimethyl ether(PEGDME)를 poly(vinylidenefluoride-co-hexafluoropropylen)(PVDF-HFP)에 첨가했는데, 이를 통해 아연 염을 용매화시키고 PVDF-HFP를 안정화하는 역할을 했다.
PVDF를 활용한 또 다른 방법으로 이온성 액체를 PVDF-HFP에 첨가하는 방법이 있는데 이는 아연 염을 완전히 용해하고 PVDF-HFP 고분자와 잘 혼합되게 한다. Xu와 연구진은 PVDF-HFP와 zinc triflate (Zn(Tf)2), 1-ethyl-3-methylimidazolium trifluoromethanesulfonate (EMITf) 또는 Zn(TFSI)2, 1-ethyl-3-methylimidzoliumbis(trifluoromethane sulfonyl)imide (EMITFSI)를 혼합해 겔 전해질을 제작했다.71) 이 전해질은 상온에서 10−3 S cm−1의 이온 전도도를 보여줬다. 이온성 액체의 첨가에 따라 PVDF 사슬과 아연 이온의 상호작용이 약해지고 이온 이동이 활발해져 높은 이온 전도도를 얻을 수 있다. 기존 무기물 첨가제보다 이온성 액체는 휘발성이 없고 PVDF와 쉽 게 융합해 아연 이온 수송을 위한 전해질로 고려될 수 있다.

(a) Schematic illustration of zinc deposition on the copper mesh in normal and PAM-added electrolytes. (b) Electro-chemical windows of the electrolytes with difference PAM concentrations. (c-f) The surface morphologies of commercial zinc foil after immersion for 7 days in the electrolyte with the PAM concentration of 0, 0.2, 1 and 5 g L−1, respectively. Reproduced from Zhang et al. Angew. Chem. Int. Ed. 2019;58:15841–15847, with permission of John Wiley and Sons [79].
4. 첨가제
전해질에 사용하는 첨가제는 균일하지 않은 아연이온 증착을 균일하게 유도해 수지상 형성을 억제해 전지의 사이클 특성을 향상하거나, 작동 전압 영역대를 넓혀 더 높은 에너지밀도를 갖게 하는 전략으로 사용된다.72) 첨가제들은 주로 유기물이나 금속이온으로 구성되어 있는데, 전류 분포를 조절하고 아연 이온의 평면적 확산을 효과적으로 제한하기 때문에 수지상 형성을 억제할 수 있다.73)
니켈(Ni)과 같은 금속이온 첨가제는 아연과 반응해 합금을 형성하여 수지상 형성을 고르게 만들어 수지상 형성으로부터 일어나는 문제를 예방하기도 한다. Frank Endres 연구진은 zinc triflate(Ni(TfO)2)를 포함하는 이온성 액체를 전해질 첨가제로 활용해 아연-니켈 합금 의 형성을 유도해 음극의 계면에서 발생하는 아연 이온의 결정핵 생성을 고르게 유도한 연구를 수행했다.74) 이외에도 아연보다 높은 전위를 가지는 Bi3+, Pd2+, Nd3+와 같은 금속 이온들은 아연보다 먼저 환원되어서 아연 증착의 기질로서 작용하고 전극의 전도성을 높여줌으로써 아연 증착을 고르게 한다.75–77) 하지만 Na2 SO4와 같은 금속염들은 산화 환원 반응에 직접적으로는 관여하지 않지만, 아연 표면에 흡착되어 정전기적 반발을 줄여 수지상 형성을 억제하고 아연 금속의 고르지 않은 용해를 예방하기도 한다.78)
유기물 첨가제 중 하나로서 PAM이 수지상 형성을 억제하는 데 기여한 연구가 있다. Haiyan Wang과 연구진은 구리-아연 고용체(solid solution)를 망사구조의 구리 집전체에 접합시키고 PAM을 첨가제로 활용해 수지상 형성을 억제한 3차원 구조의 음극 설계를 고안했다.79) 구리-아연 고용체는 아연의 증착 과정에서 결정핵 생성이 발생하는 위치를 지정하는 역할을 하고 PAM 은 전극 제조과정과 충·방전 과정에서 모두 아연 증 착이 균일하도록 유도하는 안내 중재자 역할을 한다. PAM은 먼저 구리 표면에 흡수되고 아연 이온은 PAM 사슬의 아실기(acyl groups)에 의해 표면을 이동할 수 있다. PAM으로 표면처리를 함으로써 생긴 고른 전기장과 전하 분포 때문에 아연이온은 증착 과정에서 균일하고 부드러운 모양으로 성장한다. 이 연구에서는 PAM 의 농도를 0 g L−1, 0.2 g L−1, 1 g L−1, 5 g L−1로 각각 다르게 설정하여 작동 전압 영역대와 아연 금속의 표면 분석도 진행했다. 아연 도금의 전압은 −0.103 V에서 −0.041 V로 변동되었는데 이는 아연 도금 과정에서의 PAM의 활성에 기인한다고 설명한다. 또, 산소발생반응 전압이 0.1 V 정도 향상되면서 작동 전압 영역을 확장하는 데 기여했다. 아연 호일을 PAM이 첨가된 전해질에 7일간 담가 놨을 때, PAM의 농도가 증가할수록 표면이 안정한 모습을 보였다. 이는 PAM이 아연 표면에 흡수되어 용해된 O2와 약산성의 용액으로부터 부식되는 것을 방지해준다.
유기물을 활용해 수지상 형성을 억제한 다른 연구로 Xudong Wang 그룹은 2 vol%의 diethyl ether(Et2 O)를 첨가제로 활용해 사이클 성능을 높인 연구를 수행했다.80) 아연 이온 증착 과정에서 양극화된 소량의 Et2 O 는 아연 음극 표면의 뾰족한 부분으로 흡착된다. Et2O가 없는 경우 이 부분에 아연 이온 증착이 계속해서 이루어지면서 수지상 형성을 초래한다. 하지만 흡착된 Et2 O가 이를 억제하여 음극 안정성을 갖추도록 하는 역할을 했다. Et2 O를 첨가제로 활용해 MnO2 양극과 전지를 제작했을 때, 50 mA g−1에서 첫 번째 사이클의 쿨롱 효율은 95.6%로 나타났고, 5 A g−1에서 용량은 115.9 mAh g−1으로 나타났으며, 4000 사이클 이후에도 초기 용량의 97.7%를 유지하면서 높은 충·방전 속도와 사이클 성능을 나타냈다.
고농도화 전략과 유사하게 전해질의 작동 전압 영역을 넓히는 방법으로 dimethyl sulfoxide(DMSO)를 유기물 첨가제로 활용한 사례가 있다.81) 이 연구에서는 1.6 M의 ZnCl2-H2 O 용액(ZnCl2:H2 O=1:34 몰 비)에 DMSO를 넣어 1.3 M의 ZnCl2/H2 O-DMSO(H2 O/ DMSO=4.3:1 부피 비)를 형성하도록 함으로써 아 연 이온의 용해 껍질을 채우고 있는 물 분자를 대체했다. 따라서 아연 이온이 DMSO로 먼저 용해되고, 추가로 H2 O-DMSO의 강한 상호작용이 물 분자의 분해를 막는다. 게다가 용해된 DMSO의 환원에 의한 분해는 Zn12(SO4)3 Cl3(OH)15·5H2 O, ZnSO3, ZnS가 풍부한 고체/전해질 계면 상(solid electrolyte interphase, SEI) 층을 형성해 수지상 형성도 억제한다. DMSO 첨가제를 넣고 Zn|MnO2 반쪽 전지 테스트를 했을 때, 환원이 1.15 V로 나타나면서 첨가제를 넣지 않았을 때의 값(1.22 V)보다 낮게 측정되었다. Zn|MnO2 완전지는 0.3 C로 충전되었을 때 212 Wh kg−1의 높은 에너지밀도를 보였고, 8 C에서 충·방전 되었을 때 첨가제를 넣으면 500 사이클 동안 ∼150.3 mAh g−1의 용량을 보이며 초기 용량의 95.3%가 유지되었으나 첨가제를 넣지 않으면 150 사이클 내에 용량이 급격하게 감소했다.
5. 결론
AZIB는 ESS로 적용하기 위해 LIB를 대체하는 전지로 여겨지면서 수많은 연구가 수행되고 있다. 본 총설에서는 AZIB를 구성하는 중요한 요소인 전해질에 초점을 맞춘 연구들이 소개되었다. AZIB에서 주로 문제로 여겨지는 수지상 형성 및 성장, 좁은 작동 전압 영역대, 제한된 구동 온도 조건 등과 같은 문제들을 해결하기 위해 고농도화 전략, 겔 전해질의 사용, 첨가제의 사용과 같은 전략들이 주로 연구되었다. 이로 인해 장기간의 사이클 구동이 가능해질 뿐만 아니라 높은 에너지밀도를 얻는 성과를 얻을 수 있었는데, 그 과정에서 전해질의 역할이 중요하게 다뤄졌다. 그러나 큰 규모에 적용되기에는 원가, 제조 공정 등의 요소를 고려해야 하므로 일부 연구결과가 실제 산업에 적용되기에는 어려움이 있다. 특히 고농도화 전략에서는 고농도화에 따른 점도 향상 문제가 발생할 수 있으며, 많은 양의 전해질이 투입됨에 따라 단가가 치솟는 한계점이 있다. 유연성, 기계적 안정성의 장점이 있는 겔 전해질은 액체 전해질보다 이온 전도도가 낮아 아직은 유연 전지와 같은 특수 시스템에만 국한되는 경향이 있다. 향후, 차세대 에너지 저장 장치로서 AZIB가 사용되기 위해서는 AZIB의 특장점인 빠른 충·방전 속도를 유지하고, 고에너지 밀도를 위해 높은 전압을 갖는 양극재의 개발과 더불어 양극재와 좋은 호환성을 가지는 안정적인 다기능성 전해질의 개발이 필요하다.
References
Biography

◉◉조 창 신
◉ 2014년-2021년↸↸중앙대학교↸화학신소재공학부↸학사
◉ 2021년-현재↸↸중앙대학교↸화학신소재공학부↸석박사↸통합과정

◉◉강우석
◉ 2007년-2016년 포항공과대학교 화학공학과 학사, 박사
◉ 2017년-2018년 University of Cambridge, Research Associate
◉ 2018년-2020년 University of Cambridge, Marie-Curie Fellow↸
◉ 2020년 – 현재 중앙대학교 화학신소재공학부 조교수